Algemeen
Bogin persberichten
januari 2019
Jean Hermans nieuwe Bogin voorzitter
Beschikbaarheid geneesmiddelen in Nederland is uitdaging
Artikelen / Columns / Interviews
1 februari 2023, ZonMW
Congres Goed Gebruik Geneesmiddelen 2023
'Inzet op Impact'
7 februari 2022, ZonMw
Donderdag 31 maart 2022 houdt ZonMw het congres Goed Gebruik Geneesmiddelen: 10 jaar onderweg
30 januari 2022, Radio1 Pointer
Groei tekort aan medicijnen in Nederland
13 augustus 2021, de Volkskrant
Tweede kans voor jichtmedicijn wordt door te lage prijs een gemiste kans
11 juni 2021, Pharmaceutisch Weekblad - Stichting Farmaceutische Kengetallen
Stijging aandeel generieke verstrekkingen in 2020
Merkloze middelen goed voor 79% van verstrekkingen en 23% van kosten
29 april 2021 Webinar Koninklijke Nederlandse Chemische Vereniging
Het oplopende geneesmiddelentekort in Nederland
6 april 2021 Uitnodiging Webinar 14 april Koninklijke Nederlandse Chemische Vereniging
Het oplopende geneesmiddelentekort in Nederland
22 febr 2021 Uitnodiging VIG Talk
Welke keuzes zijn nodig voor beschikbaarheid en betaalbaarheid van geneesmiddelen
9 november 2020, NCRV/De Monitor
Apothekers: huidig aantal wisselingen van medicijn risico voor gezondheid van patiënt
3 november 2020, KNMP
Bovengemiddeld aantal foutmeldingen FMD
18 juni 2020, Pharmaceutisch Weekblad, Jaargang 155 Nr 25
Aandeel generieken nam vorig jaar nauwelijks toe
18 mei 2020, FD
Medicijnen worden steeds goedkoper
17 mei 2020, Radio 1
Overheid is grip op geneesmiddelenvoorziening kwijt
7 april 2020 de Volkskrant
Moet Nederland zelf antibiotica en ibuprofen gaan maken?
5 april 2020, Radio 1
Voorraden om medicijntekorten op te lossen, komen er niet
2 april 2020, de Volkskrant.nl
Medicijnen dreigen over paar maanden op te raken door afhankelijkheid China en India
27 februari 2020, NRC Handelsblad
Hoelang voordat de pillen op zijn?
27 februari 2020, Financieel Dagblad
Medicijntekort door coronavirus kan Nederland hard raken
20 januari Pharmaceutisch Weekblad
Biosimilars: goed en goedkoper alternatief
20 januari 2020, KNMP
Persbericht: Geneesmiddelentekorten in 2019 verdubbeld
juni 2019, Medische Oncologie
‘Met biosimilars kunnen internist-oncologen jaarlijks 100 miljoen euro besparen’
augustus 2019, Instituut Verantwoord Medicijngebruik
Inzicht in biosimilargebruik met de Geneesmiddelenmonitor
27 augustus 2019, de Volkskrant
Open brief: Farmaceuten, draag steentje bij
26 juni 2019, SFK/het Pharmaceutisch Weekblad
Nieuwe introducties maken behandeling met generieke middelen gemiddeld duurder
Aandeel merkloze medicijnen in 2018 wederom toegenomen
21 maart 2019
Biosimilars op Maat in ziekenhuizen' (BOM)
15 maart 2019, het Pharmaceutisch Weekblad
Veilig switchen naar infliximab biosimilars
15 januari 2019, de Volkskrant
Tekort aan pillen weer toegenomen
20 november 2018, Vereniging Innovatieve Geneesmiddelen,
Compensatie extra kosten Falsified Medicines Directive
12 november 2018, Ministerie van VWS
Tijdelijke beleidsregels maximumprijzen geneesmiddelen ivm gedelegeerde verordening 2016/161
17 september 2018, ZONmw
Martin Favié interviewt dr. Arend Mosterd over het LoDoCo-onderzoek
13 september 2018, European Medicines Agency
Verbetering begrip van Biosimilars in Nederland
20 juli 2018, PW nr 29/30
Biosimilar van inflixamb vergelijkbaar met origineel
5 juli 2018, PW nr 27/28
Aandeel merkloze medicijnen stijgt in 2017 verder naar 76%
29 mei 2018 Het Financieele Dagblad
Brussel wil export van generieke medicijnen stimuleren
15 mei 2018, Nieuwsbrief Biosimilars Nederland #12, 2018-03
Succesvol Derde Nationaal Biosimilar Symposium
12 mei 2018, NRC
Verschraling medicijnkast dreigt
Nepmedicijnen Nieuwe EU regels tegen vervalsing van medicijnen kost de Nederlandse sector 60 tot 100 miljoen
11 mei 2018, Radio1
EU regels tegen nepmedicijnen kosten sector miljoenen
8 mei 2018, Pharmaceutisch Weekblad
'Optimaal medicijngebruik ligt voor de hand, toch gaat veel mis’
Arnold Vulto neemt na 22 jaar afscheid van het Erasmus MC
8 mei 2018, Pharmaceutisch Weekblad
Mr. Biosimilar
1 mei 2018, ZonMW
Favié over GGG Congres (19 apr jl.), met name over subsessie Drug Rediscovery
30 april 2018, Consultancy.nl
Lage prijzen van goedkope, veelgebruikte medicijnen leiden tot tekorten
Volledige nieuwsberichten

ZonMw het congres Goed Gebruik Geneesmiddelen 2023
'Inzet op Impact'
Op donderdag 30 maart organiseert ZonMw het congres Goed Gebruik Geneesmiddelen 2023 'Inzet op Impact'. Het GGG-congres is al jaren een begrip binnen het brede werkveld van geneesmiddelen(onderzoek) en heeft tot doel het halen, brengen en delen van kennis en het opdoen van inspiratie.
Ook in deze 10e editie sluit het congres aan bij de actualiteit rondom goed gebruik van geneesmiddelen, komen innovaties aan de orde en brengen we het realiseren van impact van onderzoeksresultaten voor het voetlicht. Wij verwelkomen u ook dit jaar van harte in de locatie 1931 Congrescentrum ’s-Hertogenbosch.
In de plenaire sessies is er aandacht voor Drug repurposing en Impact
Plenair belichten verschillende sprekers de actuele onderwerpen: Drug repurposing, ofwel inzet van bestaande geneesmiddelen voor nieuwe toepassingen, en Impact, het realiseren en bestendigen van onderzoeksresultaten in de praktijk.
U kunt in 3 subsessierondes kiezen uit 18 onderwerpen
Het programma is gevarieerd en belicht zoals altijd de resultaten van ZonMw- en GGG-projecten in een breed perspectief en gerelateerd aan innovatieve projecten en actuele onderwerpen uit het veld.
In 3 rondes van ieder 6 subsessies staan onderwerpen op het programma als dure geneesmiddelen, MDL-onderzoek, leefstijl en duurzaamheid, kwetsbare ouderen en personalised medicine. Een van de rondes richt zich op interactieve wijze op onderwerpen als Impact, Richtlijnen, HTA en Gender. In iedere subsessie is er ruimte voor discussie of kunt u bijdragen via een andere vorm van interactiviteit.
Het GGG-congres is interessant voor het gehele werkveld rondom geneesmiddelen
Het jaarlijkse GGG-congres is bij uitstek een plek voor uitwisseling van kennis rondom geneesmiddelen op het snijvlak van onderzoek, praktijk en beleid en is daarnaast een dag van ontmoeten, bijpraten en netwerken.
De aanmelding is geopend
U bent van harte welkom tijdens deze congresdag. Meld u aan, laat u inspireren en blijf op de hoogte van de ontwikkelingen binnen het veld van geneesmiddelen.
Wilt u zich aanmelden?
Deelname aan het congres is kosteloos. Wel dient u zich vooraf in te schrijven. U kunt zich tot donderdag 23 maart 2023, 9.00 uur aanmelden voor het congres. In het aanmeldingsformulier geeft u aan welke sessies u wilt bijwonen. Let op: Wanneer u zonder opgaaf van reden niet op het congres verschijnt, kunnen wij u een bedrag van € 50,- in rekening brengen voor de gemaakte kosten.
Accreditatie
Accreditatie is aangevraagd op basis van het programma:
huisartsen, medisch specialisten, openbare apothekers, ziekenhuisapothekers, apothekersassistenten, farmaceutisch consulenten, verpleegkundigen en verzorgenden en verpleegkundig specialisten.
Op donderdag 31 maart 2022 houdt ZonMw het congres Goed Gebruik Geneesmiddelen:
10 jaar onderweg!
Het jaarlijkse GGG-congres besteedt aandacht aan de actualiteit rondom gepast gebruik van geneesmiddelen. Het congres heeft tot doel het halen, brengen en delen van kennis en het opdoen van inspiratie vanuit een veelheid aan aspecten rondom (onderzoek naar) geneesmiddelen. Omdat het GGG-programma 10 jaar bestaat zullen we daar tijdens dit congres ook veel aandacht aan besteden. Meer dan ooit komen opbrengsten en impact vanuit lopende en afgeronde onderzoeksprojecten aan de orde. We hebben voor u een uitdagend en divers programma samengesteld op een nieuwe locatie.
Plenaire thema’s: FAST en 10 jaar GGG
Tijdens de plenaire ochtendsessie staat FAST centraal. Een mooi en toepasselijk acroniem voor ‘Future Affordable and Sustainable Therapies’; een onafhankelijk nationaal platform voor innovatieve therapieontwikkeling, dat bestaande activiteiten met elkaar verbindt en nieuwe activiteiten initieert om het gehele proces van therapieontwikkeling te ondersteunen en optimaliseren. Diverse betrokkenen vanuit dit vernieuwende initiatief, ondersteund door de ministeries van VWS en EZ, gaan in op de positionering en prioriteiten van FAST en hoe dit platform gaat zorgen voor ontsluiting van beschikbare kennis en expertise, optimalisatie van de infrastructuur en coördinatie van publieke middelen voor therapieontwikkeling. En hoe wordt aangesloten op internationale initiatieven en ontwikkelingen.
’s Middags komt plenair 10 jaar GGG-programma aan bod. Onder leiding van dagvoorzitter Joost Hoebink wordt u meegenomen in het 10-jarig bestaan van het GGG-programma, van start tot heden en met natuurlijk ruimte voor de blik naar de toekomst. Het GGG-programma is tenslotte pas 10 jaar onderweg.
Het programma gekeken naar de subsessies is gevarieerd en belicht zoals altijd de resultaten van GGG-projecten en andere innovatieve onderzoeksprojecten. De onderwerpen variëren van opioïden, drug rediscovery en eHealth, tot big data, geneesmiddeleninformatie, afbouwstrategieën en dure geneesmiddelen.
Kom naar het GGG-congres 2022, ontmoet collega’s uit het brede veld van geneesmiddelen en wissel kennis met elkaar uit.
Kijk voor alle informatie en voor inschrijven:
GGG-congres 2022: 10 jaar onderweg!
Wilt u zich aanmelden?
Deelname aan het congres is kosteloos. Wel dient u zich vooraf in te schrijven. U kunt zich tot donderdag 24 maart 2022, 9.00 uur aanmelden voor het congres. In het aanmeldingsformulier geeft u aan welke sessies u wilt bijwonen. Let op: Wanneer u zonder opgaaf van reden niet op het congres verschijnt, kunnen wij u een bedrag van € 50,- in rekening brengen voor de gemaakte kosten.
Accreditatie
Accreditatie is aangevraagd op basis van het programma: huisartsen, medisch specialisten, openbare apothekers, ziekenhuisapothekers, apothekersassistenten, farmaceutisch consulenten, verpleegkundigen en verzorgenden en verpleegkundig specialist.
Vragen & informatie
Heeft u inhoudelijke vragen over de dag zelf, dan kunt u terecht bij de communicatiemedewerkers van het programma Goed Gebruik Geneesmiddelen:
• geneesmiddelen@zonmw.nl, Mariëtte van Wijk en Marieke van Gelderen, 070 349 54 64
Heeft u een praktische vraag, bijvoorbeeld over aan- of afmelding of bereikbaarheid? Stelt u deze dan aan:
• geneesmiddelen@odetteorganiseert.nl, Odette Organiseert, 06 250 652 98
30 januari 2022, Radio1 Pointer
Door de jaren heen groeit het tekort aan medicijnen in Nederland. Onder andere als gevolg van beleid om de prijzen te drukken. Dat beleid werkt niet meer, zeggen Aris Prins van de KNMP en Jean Hermans van de Bogin. Luister hier terug: https://tinyurl.com/pointer-medicijnen
13 augustus, de Volkskrant
Tweede kans voor jichtmedicijn wordt door te lage prijs een gemiste kans

FABRIKANTEN WILLEN ONDERZOEK NAAR NIEUWE TOEPASSINGEN VAN BESTAANDE MEDICIJNEN NIET MEER FINANCIEREN ALS ZE DE INVESTERINGEN NIET KUNNEN TERUGVERDIENEN. FOTO HH
Veelbelovende medicijnen dreigen in Nederland niet op de markt te komen omdat de prijs te laag is. Het gaat om bestaande, alledaagse geneesmiddelen die na onderzoek ook bij een andere ziekte blijken te werken. Farmabedrijven weigeren nog langer bij te dragen aan onderzoek, omdat ze hun investeringen niet kunnen terugverdienen.
Onderzoek naar een tweede kans voor bestaande medicijnen heeft internationaal een hoge vlucht genomen. Groot voordeel is dat die middelen al zijn getest op veiligheid én goedkoop zijn omdat ze van het patent af zijn. 'Dit soort onderzoek heeft alles in zich', zegt hoogleraar cardiologie Jan-Hein Cornel (Radboudumc), 'maar het dreigt nu spaak te lopen.'
Dat wordt duidelijk nu een eerste Nederlands succes is geboekt. Eind 2020 publiceerde vakblad The New England Journal of Medicine de resultaten van een Australisch-Nederlands onderzoek onder vijfduizend patiënten, waaruit blijkt dat het jichtmedicijn colchicine de kans op een hartinfarct bij risicopatiënten flink kan reduceren. Het onderzoek was deels gefinancierd door ZonMw, dat namens het ministerie van Volksgezondheid opereert. Nederlandse farmabedrijven investeerden er 4 miljoen euro in.
3 euro per patiënt
De bedrijven zeggen dat hun vooraf door het ministerie was toegezegd dat er naar een oplossing zou worden gezocht om dat bedrag terug te verdienen. Omdat colchicine van het patent af is, verdienen ze er nauwelijks nog aan, ze krijgen 3 euro per jichtpatiënt per maand. Als ze een tijdlang iets meer geld kunnen krijgen voor elke hartpatiënt die het middel krijgt voorgeschreven, zijn ze uit de kosten. Maar het ministerie heeft onlangs laten weten dat de Geneesmiddelenwet en het vergoedingssysteem dat verhinderen: dezelfde pil mag bij een andere groep patiënten niet duurder zijn.
De fabrikanten willen nu nieuw onderzoek dat op stapel staat niet meer financieren. 'Wij hoeven geen enorme winst te maken, maar als we na een succes onze investeringen niet kunnen terugverdienen, dan houdt het op', zegt Guido van der Aar, directeur van Disphar, een van de investeerders.
Voor het onderzoek naar hergebruik van geneesmiddelen is de financiële bijdrage en de kennis van fabrikanten onontbeerlijk. Dergelijk onderzoek kost weliswaar een fractie van wat grote farmaceuten investeren in de zoektocht naar een nieuw medicijn, maar naast overheidssubsidies zijn vaak nog miljoenen euro's nodig van externe financiers. Die lopen een risico, want lang niet elk tweedehands middel heeft elders succes.
Dat de fabrikanten afhaken, heeft ook direct gevolgen voor patiënten. Om de succesvolle jichtpil aan hartpatiënten te kunnen voorschrijven moet die pil eerst bij de medicijnautoriteiten worden geregistreerd voor hart- en vaatziekten. Zo'n registratie kost geld. Nu ze voor hun investeringen niets terugkrijgen, zien de fabrikanten daar vanaf.
'Dus we steken hier kennis en energie in, de minister stimuleert onderzoek, de gezondheidswinst is groot, maar geen enkele nieuwe toepassing heeft de patiënt nog bereikt', concludeert Jean Hermans, voorzitter van Bogin, de koepelorganisatie van fabrikanten van generieke medicijnen.
Het ministerie van Volksgezondheid noemt het onderzoek naar tweedekansmedicijnen in een reactie 'veelbelovend'. Het ministerie erkent dat fabrikanten minder mogelijkheden hebben om onderzoeks- en registratiekosten terug te verdienen, omdat octrooien op de medicijnen vaak zijn verlopen. 'Dat mag alleen geen drempel opwerpen', aldus een woordvoerder.
Het ministerie is daarom in gesprek met alle betrokken partijen, van artsen en wetenschappers tot het College ter Beoordeling van Geneesmiddelen en farmaceuten. 'We willen een aantrekkelijk investeringsklimaat creëren voor private partijen, in het belang van de patiënt, maar dat is wel een gezamenlijke verantwoordelijkheid.'
11 juni 2021, Pharmaceutisch Weekblad - Stichting Farmaceutische Kengetallen
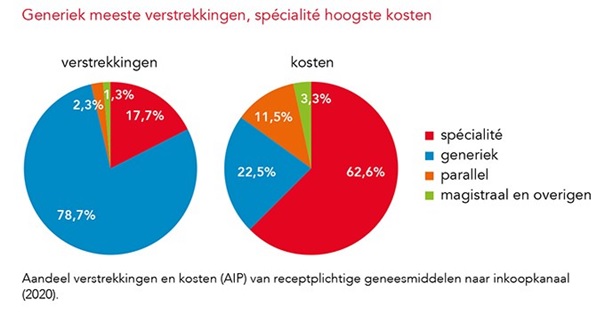
Stijging aandeel generieke verstrekkingen in 2020
Merkloze middelen goed voor 79% van verstrekkingen en 23% van kosten
Het aandeel van de verstrekkingen met een generiek geneesmiddel is in 2020 gestegen met 0,7%-punt tot 78,7% ten opzichte van 2019. Een behandeling met een generiek geneesmiddel kostte in 2020 gemiddeld € 3,53 per maand, een toename met 21 eurocent. Aldus het SFK in het Pharmaceutisch Weekblad.
Een generiek geneesmiddel is een (meestal merkloze) variant van een spécialité dat op de markt mag worden gebracht als het patent van het spécialité is verlopen. Prijzen van generieke geneesmiddelen zijn meestal lager dan die van spécialités. Zo maakten generieke middelen in 2020 22,5% uit van de geneesmiddelkosten op basis van de apotheekinkoopprijs.
Spécialités waren goed voor 62,6% van de kosten, terwijl slechts 17,7% van alle receptplichtige verstrekkingen van openbare apotheken op hun conto komt. Een behandeling met een generiek geneesmiddel kostte vorig jaar gemiddeld € 3,53 per maand, 6,4% meer dan in 2019. Ook de gemiddelde kosten van een behandeling met een spécialité namen toe, met 4,9% naar € 38,23 per maand.
Binnen de generieken waren er vorig jaar drie geneesmiddelen die goed waren voor een kwart van de kostentoename. Voor alle drie de middelen geldt dat de kostenstijging bij de generieke varianten gepaard ging met een grotere kostendaling bij de spécialités. Netto vielen de totale kosten voor deze middelen dus lager uit dan in 2019.
Cinacalcet
Cinacalcet, dat wordt toegepast bij nierziekte en bepaalde bijschildklierziekten, was de grootste stijger. Sinds het beschikbaar komen van generieke varianten van dit middel in juni 2019 is gemiddeld vijf keer zoveel besteed aan de merkloze varianten als aan het merkmiddel. Niettemin zorgde de introductie van generieke varianten voor een totale besparing van € 1,6 miljoen.
Door toegenomen gebruik van generiek octreotide, een middel dat wordt toegepast bij bepaalde soorten kanker, werd in 2020 ongeveer vijf keer zoveel uitgegeven aan een merkloze variant als in 2019. Dit is vooral ten koste gegaan van het aandeel parallelimport, dat in 2020 bijna is verdwenen. De totale kosten van octreotide daalden met € 1,4 miljoen.
De introductie van goedkopere generieke varianten van solifenacine, een middel tegen aandrangincontinentie, per juli 2019 leidde tot een besparing van € 4,4 miljoen.
29 april 2021 Webinar Koninklijke Nederlandse Chemische Vereniging
Het oplopende geneesmiddelentekort in Nederland
Kijk het webinar van KNCV met Jean Hermans van Bogin terug. Klik hier.
6 april 2021 Uitnodiging Webinar Koninklijke Nederlandse Chemische Vereniging
Het oplopende geneesmiddelentekort in Nederland
In dit webinar neemt Jean Hermans van Bogin je mee in de wet- en regelgeving (uit 1990!) rondom geneesmiddelenvergoeding en -prijzen die nog steeds van kracht zijn. En legt uit hoe deze verouderde wetgeving zorgt voor leveringsproblemen. Volgens Bogin is het tijd voor nieuw beleid en in het webinar vertelt hij hoe dat eruit moet komen te zien.
.jpg)
Jean Hermans beantwoordt in het webinar onder meer de volgende vragen:
- Hoe werkt het huidige systeem een geneesmiddelentekort in de hand?
- Welke invloed heeft de Noorse kroon op de beschikbaarheid van geneesmiddelen in Nederland?
- Welk effect heeft de inkoopmacht van de zorgverzekeraars op de beschikbaarheid van geneesmiddelen?
- Hoe kan marktwerking het geneesmiddelentekort helpen oplossen?
Op woensdag 14 april zoomt Jean Hermans is voorzitter van Bogin in op 'Het oplopende geneesmiddelentekort in Nederland' en zal hij over bovenstaande vragen beantwoorden. Aan het eind van zijn presentatie kun je zelf ook vragen stellen. Deelnemen kan via Zoom en Youtube. Via Youtube kun je zonder aanmelden kijken via www.youtube.nl/thekncv. Aanmelden voor Zoom, klik hier.
22 febr 2021 Uitnodiging VIG Talk
Welke keuzes zijn nodig voor beschikbaarheid en betaalbaarheid van geneesmiddelen
Welke keuzes zijn er nodig als het gaat om beschikbaarheid en betaalbaarheid van geneesmiddelen? Dát is de rode draad van de VIG Talk op donderdag 4 maart, van 16.00 tot 17.00 uur. Aanmelden is al mogelijk! Onderwerpen als GVS, WGP en medicijntekorten zullen de revue passeren. De sprekers zijn deze keer: Jean Hermans (voorzitter Bogin) en Wim de Haart (manager gezondheidseconomie en vergoedingen bij de VIG).
In een korte inleiding schetst Jean Hermans de historie. Hoe was het geneesmiddelenvergoedingssysteem oorspronkelijk bedoeld? En hoe functioneert het nu, met het oog op betaalbaarheid en beschikbaarheid?
Vervolgens geeft Wim de Haart in een korte inleiding zijn visie op de knelpunten van het huidige systeem,
om vervolgens meteen zijn visie te geven op oplossingsrichtingen.
Ontwikkelingen als personalised medicine en cel- en gentherapie blijven hierbij uiteraard niet onbesproken.
U kunt beide heren via de chat vragen stellen. We kijken – net als bij de vorige twee VIG Talks – met
een schuin oog naar de verkiezingen van 17 maart en het volgende regeerakkoord.
Kortom: reden genoeg om mee te doen met deze korte en krachtige online meeting! Luister en chat
mee en klik alvast op de aanmeldlink. Wie is aangemeld, ontvangt enkele uren voor de VIG Talk een
deelnamelink. Graag tot 4 maart!
Met vriendelijke groet,
Gerard Schouw
directeur Vereniging Innovatieve Geneesmiddelen
Aanmelden
9 november 2020, NCRV/De Monitor
Apothekers: huidig aantal wisselingen van medicijn risico voor gezondheid van patiënt
Veel apothekers vinden dat de mate waarin patiënten nu overstappen op een ander medicijn met dezelfde werkzame stoffen, een risico vormt voor de gezondheid. Het kan leiden tot verkeerde inname en gezondheidsklachten. Dat blijkt uit een vragenlijst van het tv-programma De Monitor (KRO-NCRV) onder 1.132 apothekers. Volgens hen is het “doorgeslagen” beleid dat zorgverzekeraars uitvoeren een belangrijke oorzaak van het wisselen.
“We merken dagelijks aan de balie dat mensen verward reageren wanneer we uitleggen dat ze een ander merk medicijn krijgen dan voorheen”, zegt Aris Prins, voorzitter van de apothekersorganisatie Koninklijke Nederlandse Maatschappij ter bevordering der Pharmacie (KNMP) tegen het tv-programma. “Als we op huisbezoek gaan, zien we dat alle medicijnen soms door elkaar liggen. We zien ook vaak dat wanneer er medicijnen worden teruggebracht, er verschillende doosjes niet, of te veel gebruikt zijn. En we merken dat mensen onregelmatig terugkomen voor een herhaalrecept, er zit geen lijn in.”
92 procent van de ondervraagde apothekers geeft aan dat de huidige frequentie van wisselen een risico is voor de gezondheid van patiënten, en dat er te vaak gewisseld wordt, zo blijkt uit een vragenlijst die ingevuld is door 1.132 apothekers die lid zijn van de KNMP. Het gaat om wisselingen tussen medicijnen met dezelfde werkzame stoffen waarvan de hulpstoffen kunnen verschillen. Soms kunnen er bijwerkingen optreden. Ook kan de vorm of kleur anders zijn, waardoor mensen in de war kunnen raken en hun medicijn verkeerd of helemaal niet meer innemen.
Jaarlijks wordt er miljoenen keren gewisseld, vaak omdat een ander medicijn goedkoper is. Volgens de apothekers is het uitgevoerde beleid door zorgverzekeraars een belangrijke oorzaak van de wissel. “Mensen snappen vaak niet dat ze moeten wisselen”, aldus Prins, “en het uitleggen kost ons enorm veel tijd.” De meeste bevraagde apothekers (83 procent) geven aan een of meerdere keren per dag discussies te hebben met patiënten over de wisseling vanwege het beleid van zorgverzekeraars.
Bijna alle ondervraagden (97 procent) vinden het beleid van zorgverzekeraars doorgeslagen. “De zorgverzekeraars zijn in de markt gezet om het prijsbeleid zo hard mogelijk te drukken”, stelt Prins, “en dat doen ze goed. Wij zitten in een race-to-the-bottom waarbij het op medicijnniveau om centenmarges gaat.”
Wat ik zie, is dat sommige middelen worden gewisseld waarvan ik denk dat het niet verstandig is Jako Burgers, Nederlands Huisartsen genootschap. “Wij hebben aangetoond dat we met z'n allen de kosten van de geneesmiddelen beperkt kunnen houden. Maar het slaat door”, zegt Jako Burgers van het Nederlands Huisartsen Genootschap tegen De Monitor. “Wat ik zie, is dat sommige middelen worden gewisseld waarvan ik denk dat het niet verstandig is. Het risico is dat de middelen uiteindelijk minder goed gebruikt worden.”
“Wij hebben als zorgverzekeraar een belangrijke maatschappelijke opdracht om te zorgen dat de zorg betaalbaar blijft”, zegt directeur Petra van Holst van Zorgverzekeraars Nederland tegen het tv-programma. “We betalen op dit moment ongeveer 50 euro per jaar minder zorgpremie, omdat wij de inkopen op de medicijnen hebben gedaan.”
Ze vindt dat apothekers als zorgverleners een belangrijke rol spelen in het begeleiden van de patiënt bij het wisselen. Van Holst: “Wij maken altijd de afweging wat het met de kosten doet ten opzichte van het belang van wel of niet wisselen voor patiënten. Als het wisselen een risico zou zijn, dan moet de huisarts in overleg met de apotheker kijken wat voor die patiënten wél acceptabel zou zijn.”
3 november 2020, KNMP
Bovengemiddeld aantal foutmeldingen FMD
Nederlandse apotheken registreren bij het scannen van geneesmiddelen een bovengemiddeld aantal foutmeldingen. Dat blijkt uit data van de Stichting Nederlandse Medicijnen Verificatie Organisatie (NMVO). Het percentage foutmeldingen in de ons omringende landen ligt op 0,6 procent, in Nederland is dat 2 procent.
Volgens de NMVO is het van belang het grote aantal onterechte foutmeldingen te verlagen, zodat alleen zogenaamde ‘alerts’ van vermoedelijk vervalste geneesmiddelen overblijven. Bovendien geeft elke alert aan fabrikanten, registratiehouders en IGJ onnodig inzage in apotheekdata. Anderhalf jaar geleden hebben apothekers de gedetailleerde regels voor veiligheidskenmerken volgend uit de Europese richtlijn Falsified Medicines Directive (FMD) in hun apotheekinformatiesysteem (AIS) geïmplementeerd.
Oorzaken foutmeldingen
Het gemiddeld aantal foutmeldingen op gescande geneesmiddelen in Nederland is met 2 procent meer dan drie keer zo hoog als het Europese gemiddelde van 0,6 procent. Uit de eerste inzichten blijkt de meerderheid van de alerts te ontstaan door foutieve scan-informatie. Hierbij zet de 2D scan hoofdletters (in bijvoorbeeld een serienummer of batchnummer) niet goed door naar het softwaresysteem. De scanner configureren biedt in de meeste gevallen uitkomst. Apotheken kunnen daarnaast met de FMD-tool vaak de oorzaak van de foutmelding achterhalen. Deze tool kampte aanvankelijk met kinderziektes; NMVO start binnenkort met een verbetering en verfijning van de tool.
Oplossingen in systeem of scanapparaat
De NMVO verzoekt apotheekhoudenden die veel foutmeldingen in hun systeem zien, eerst contact te leggen met de AIS- of techniekleverancier over de instellingen van het systeem of scanapparaat. Apotheken kunnen daarnaast zelf een check doen op hun interne processen door deze na te lopen, bijvoorbeeld als er sprake is van meerdere aansluitingen op één locatie. Daarna kan de apotheker zich voor hulp wenden tot de NMVO via apotheek@nmvo.nl.
Top 40- en integrale aanpak
Voor hulp bij foutmeldingen aan apotheken heeft de KNMP de zogenaamde Top 40-aanpak in gang gezet. Op basis van een (anonieme) rapportage van NMVO, heeft de KNMP 40 apotheken benaderd die een hoog aantal foutmeldingen lieten zien. Het aantal alerts is bij deze apotheken daarna gedaald; de oorzaken waren relatief makkelijk op te lossen. Er is echter meer nodig om ervoor te zorgen dat het totaal aantal van 2 procent foutmeldingen in Nederland daalt. De KNMP staat een integrale aanpak voor waarbij AIS-leveranciers, NMVO, apothekers en ook de Inspectie Gezondheidszorg en Jeugd (IGJ) samen foutmeldingen analyseren. De KNMP is op zoek naar apotheken die aan dit onderzoek willen meewerken. Apothekers kunnen hiervoor een mail sturen naar: fmd@knmp.nl.
Kostenonderzoek VWS
Nu er voldoende apotheekhoudenden zijn aangesloten op NMVS en het systeem draait, is het ministerie van VWS het kostenonderzoek gestart. Systematische Integriteitsrisicoanalyse (SIRA) voert het onderzoek uit en is op zoek naar apotheekhoudenden die SIRA digitaal kan interviewen.
Het onderzoek gaat over de kosten die de apotheekhoudenden maken of gemaakt hebben in het kader van de uitvoering van de FMD. SIRA zal onder meer vragen naar de handelingen die uitgevoerd moeten worden, wie de handelingen uitvoert en hoeveel tijd die ongeveer kosten. Het is van belang dat VWS een zo’n goed mogelijk beeld krijgt van deze kosten. Het kostenonderzoek is een voorwaarde voor de vergoeding via de contracten met zorgverzekeraars. Apothekers die mee willen doen aan het kostenonderzoek van VWS kunnen dat kenbaar maken door een mail te sturen naar: fmd@knmp.nl.
Het onderzoek moet eind 2020 zijn afgerond. Het betreft hier een ander onderzoek dan het eerder door Roland Berger, op verzoek van KNMP, uitgevoerde kostenonderzoek. Dat onderzoek is voorafgaand aan de implementatie afgerond.
Toezichtsactiviteiten IGJ
De KNMP is met de IGJ in gesprek over een gewenste verbetering van het systeem rondom de foutmeldingen. Daarnaast overlegt de KNMP met de IGJ over de toezichtactiviteiten die IGJ, mogelijk dit najaar, nog gaat inzetten bij apotheken op naleving van de FMD-regels.
18 juni 2020, Pharmaceutisch Weekblad, Jaargang 155 Nr 25
Aandeel generieken nam vorig jaar nauwelijks toe
Het aandeel van de verstrekkingen met een generiek middel is in 2019 met 0,2%-punt gestegen tot 77,9% ten opzichte van een jaar eerder. Historisch gezien is dat een zeer beperkte stijging. Een behandeling met een generiek geneesmiddel kostte in 2019 gemiddeld € 3,32 per maand, een stijging met € 0,25. Dat schrijft de SFK deze week in het Pharmaceutisch Weekblad.
De genoemde 77,9% is het aandeel van alle verstrekkingen door openbare apotheken van receptplichtige geneesmiddelen in het basispakket dat een generiek (meestal merkloos) geneesmiddel betreft. Prijzen van generieke geneesmiddelen zijn doorgaans veel lager dan die van spécialités. Zo waren generieke middelen in 2019 verantwoordelijk voor 21,5% van de geneesmiddelkosten op basis van de apotheekinkoopprijs (AIP). Spécialités waren goed voor 18,0% van de verstrekkingen en verantwoordelijk voor 63,1% van de kosten.
Een behandeling met een spécialité kostte in 2019 gemiddeld bijna € 35 per maand, terwijl dat voor een generiek geneesmiddel € 3,32 was. Dat laatste bedrag is € 0,25 hoger dan in 2018. Dit kan mede worden verklaard door een gemiddelde prijsstijging met ongeveer 4% van alle generieke geneesmiddelen in de eerste maanden van 2019. Die stijging werd waarschijnlijk veroorzaakt door toegenomen verpakkingskosten, die leveranciers moesten maken als gevolg van Europese regelgeving ter bestrijding van geneesmiddelvervalsingen. Die maatregel is in de loop van 2019 van kracht geworden en moet garanderen dat gebruikers altijd een authentiek geneesmiddel ontvangen.
Singlesource
Singlesource-geneesmiddelen zijn geneesmiddelen waarvan minder dan twee generieke varianten op de markt beschikbaar zijn. Omdat generieke geneesmiddelen na het verlopen van een patent vaak door meerdere leveranciers worden geïntroduceerd, behoren ze meestal tot de categorie multisource. Het blijkt echter dat het in toenemende mate singlesource-geneesmiddelen zijn omdat generieke varianten steeds vaker door hun aanbieders van de markt worden gehaald. Het gaat dan vooral om middelen waarvan het patent al lang geleden is verlopen en waarvan het spécialité niet meer beschikbaar is.
Het aandeel van de generieke verstrekkingen dat een singlesource-middel betreft, is in 2019 fors toegenomen: van 6,6% naar 9,4%. Bij leveringsproblemen van een generiek middel is het daarom steeds minder vanzelfsprekend dat nog een ander product met dezelfde werkzame stof(fen), sterkte(s) en toedieningsvorm op de markt beschikbaar is.
Generiek meeste verstrekkingen, spécialité meeste kosten
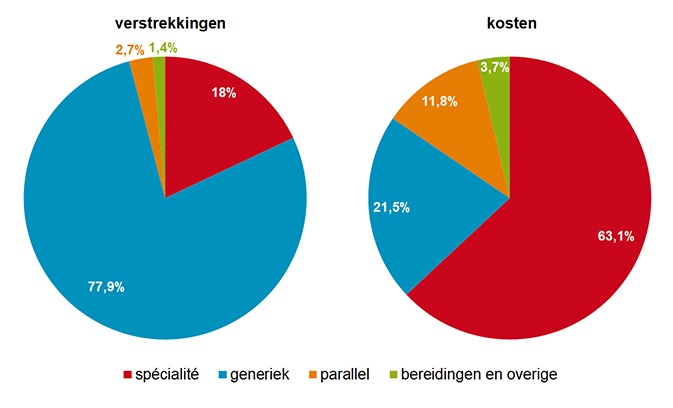
Bron: Stichting Farmaceutische Kengetallen
Aandeel verstrekkingen en kosten (AIP) van receptplichtige geneesmiddelen naar inkoopkanaal (2019)
FD, 18 mei 2020
Medicijnen worden steeds goedkoper
De hoge prijzen van medicijnen maken de zorg onbetaalbaar; het is een hardnekkige mythe. De werkelijkheid is anders. De totale Nederlandse uitgaven aan medicijnen stijgen niet extreem snel en maken sowieso maar een beperkt deel — circa 8% — uit van de totale zorgkosten.
Het verschil tussen werkelijkheid en mythe blijkt nog groter dan gedacht, zo laten een paar recente rapporten zien. Want in werkelijkheid stijgen de medicijnkosten helemaal niet. Ze dalen. Dat wil zeggen: de uitgaven per patiënt dalen. Dat de totale uitgaven stijgen, komt door een snelle toename van het aantal patiënten, onder meer door vergrijzing.
Het valt onder meer te lezen in een rapport dat accountants- en adviesfirma Deloitte deze maand publiceerde, met cijfers over ziekenhuismedicijnen. De kosten van deze relatief dure medicijnen zijn gedaald van €10.100 per patiënt in 2014 naar €6.200 in 2018. Een daling van 40%.
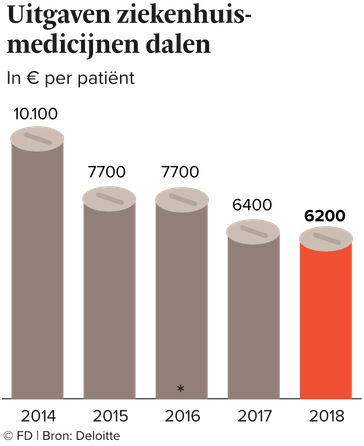
Dat de totale uitgaven toch zijn gestegen, komt door een enorme toename van het aantal patiënten. Een ruime verdubbeling zelfs, van 168.000 patiënten naar 348.000. De totale kosten van ziekenhuismedicijnen stegen daardoor in vijf jaar tijd van €1,7 mrd naar €2,2 mrd. Bij gelijkblijvende uitgaven per patiënt waren de totale kosten uitgekomen op €3,5 mrd.
Nu is het rapport van Deloitte geschreven in opdracht van de farmaceutische industrie, in de hoedanigheid van hun brancheorganisatie Vereniging Innovatieve Geneesmiddelen. Scepsis is dus op zijn plaats. Want de conclusie komt de farmabedrijven natuurlijk erg goed uit. Die kunnen met het Deloitte-rapport in de hand zeggen: zie je nu wel, we zijn onschuldig.
Maar toeval of niet, recentelijk verschenen nog twee andere rapporten met vergelijkbare uitkomsten. Zo concludeerde ook het CBS vorige maand in een trendanalyse dat de uitgaven aan ziekenhuismedicijnen per patiënt zijn gedaald. Van €11.270 in 2013 tot €8.160 in 2017.
En vorige maand kwam de Nederlandse Zorgautoriteit met zijn jaarlijkse geneesmiddelenmonitor. Daaruit bleek dat de uitgaven aan dure medicijnen per patiënt zijn gedaald van €7.900 in 2017 tot €7.800 in 2018. Ook de NZa concludeert dat een stijgend aantal patiënten de stijgende uitgaven aan geneesmiddelen veroorzaakt.
Hoe kan het dan dat de mythe over dure medicijnen die de zorg onbetaalbaar maken, toch zo hardnekkig in stand blijft? Dat komt doordat de introductie van goedkopere versies van bestaande medicijnen zelden nieuws zijn. Terwijl de lancering van enkele peperdure, nieuwe medicijnen veel aandacht krijgen. Al zijn dat vaak middelen voor (zeer) kleine patiëntengroepen die nauwelijks invloed hebben op de totale uitgaven.
17 mei 2020 Radio 1
Overheid is grip op geneesmiddelenvoorziening kwijt
Een brood is duurder dan een antibiotica kuur. "Iets" gaat er niet goed met de geneesmiddelenvoorziening. Er is al zeven jaar een oplopend tekort van medicijnen die er niet zijn, langdurig niet of helemaal niet meer. De afgelopen jaren zijn de prijzen van generieke geneesmiddelen met 35 procent gedaald, zo blijkt uit de cijfers van de Stichting Farmaceutische Kengetallen:
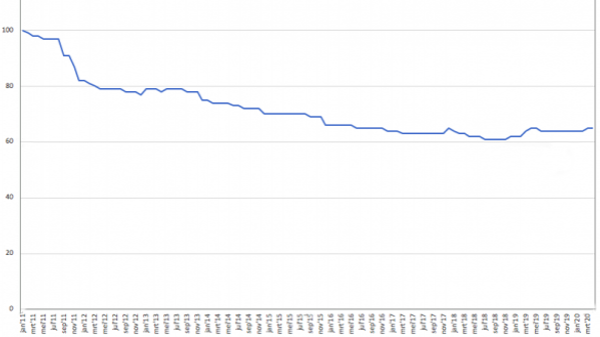
Geneesmiddelen worden op de markt gebracht door twee partijen, de Big Farma zoals ze vaak worden genoemd, leveranciers van 20 procent van vooral de dure medicijnen met een patent. En de generieke industrie, die geneesmiddelen levert waarvan het patent af is, waardoor ze goedkoop zijn. En 80 procent van alle geneesmiddelen die we gebruiken, is een goedkoop generiek medicijn.
Marktwerking
Tot 2006 had Nederland een zorgstelsel met ziekenfonds. Sindsdien hebben we een zorgverzekering en marktwerking. We geven per jaar ongeveer 80 miljard euro uit aan zorg waarvan 5 miljard euro aan farmacie (geneesmiddelen buiten het ziekenhuis). De inzet van de overheid is erop gericht de kosten van de farmacie te beheersen. Maar de veelheid aan beleid heeft een onbedoeld negatief effect op de generieke geneesmiddelen.

Bob Beekman, Teva Haarlem: het effect van te lage medicijnprijzen
En daar hebben patiënten last van. Bijvoorbeeld: als het epilepsie medicijn dat je normaal gebruikt er niet is, dan krijg je een vervangend middel. Maar dat ken je niet en dat maakt je angstig. Kun je nog wel autorijden, krijg je niet toch een aanval? Die onrust doet afbreuk aan het vertrouwen in de behandeling en zorgt voor gezondheidsrisico’s.
Tekorten
De directe reden van de medicijntekorten is het feit dat heel veel medicijnen gemaakt worden in China en India. De afhankelijkheid van deze landen die voor de hele wereld produceren is een risico. De indirecte reden van tekorten is de combinatie van verschillende wet- en regelgeving, zoals het preferentiebeleid, de Wet op de Geneesmiddelenprijzen en het Geneesmiddelvergoedingensysteem. Ieder voor zich om een probleem op te lossen, maar samen de oorzaak van een nieuw probleem: medicijntekorten.

Evelyn Schuil-Vlassak, apotheker: het systeem moet veranderd omdat...En nu?
De apothekersvereniging KNMP, de Bond van generieke leveranciers Bogin en BGPharma, de groothandelaren zijn het er over eens dat de (te) lage prijzen de Nederlandse geneesmiddelenvoorziening kwetsbaar maakt. De Patiëntenfederatie Nederland noemt dat "ver doorgevoerde kostenefficiëntie". De oplossingen die deze vier voorstellen zijn: aanpassen van beleid, voorraden aanleggen en geneesmiddelenproductie naar Europa verplaatsen.
Ook Tweede Kamerleden van D66, VVD en SP zijn voor het aanleggen van voorraden én productie in Europa. De VVD is de enige die vindt dat het preferentiebeleid aangepast moet worden. De SP pleit voor een landelijke nationale inkooporganisatie. Het CDA wil een lijst van kritische geneesmiddelen.
Toekomst
Op 30 april is bekendgemaakt dat er voor de komende 3 à 4 jaar een bedrag van 15 miljoen euro is vrijgemaakt om medicijnvoorraden aan te leggen voor medicijn die buiten het ziekenhuis worden voorgeschreven. In 2019 is er in een rapport in opdracht van VWS echter becijferd dat er 50 miljoen euro per jaar nodig is. Het blijft dus de vraag of die voorraden er zullen komen. Er komt in ieder geval Europees onderzoek naar geneesmiddel-tekorten.
Lees hier de antwoorden van minister Van Rijn van Volksgezondheid naar aanleiding van deze uitzending. Samengevat: de minister vindt niet dat wet- en regelgeving de oorzaak is van tekorten. Wel erkent hij dat 'afzetzekerheid' voor fabrikanten een rol speelt bij de vraag of ze aan Nederland leveren. Ook vindt Van Rijn het belangrijk dat er voorraden worden aangelegd en geneesmiddelen-productie naar Europa wordt verplaatst. Hij maakt zich daar in Europees verband hard voor.
Klik hier voor de Radio1 site met de audiofragmenten.
de Volkskrant, 7 april 2020
Moet Nederland zelf antibiotica en ibuprofen gaan maken?
Column Peter de Waard
Philips-topman Frans van Houten vroeg zich vorige week af of het concern direct een fabriek voor beademingsapparatuur in elk land moet gaan bouwen. Nu is die productie geconcentreerd in de VS, waar Trump dreigt beslag te laten leggen op de apparaten on der het motto America First.
Ook in de farmacie is deze vraag in deze crisis ineens nijpend geworden: moet Nederland zelfvoorzienend zijn voor antibiotica, paracetamol en ibuprofin die nu vrijwel alleen in Azië worden gemaakt?
Ondoenlijk natuurlijk. Bedrijven kunnen moeilijk in 200 landen in de wereld fabrieken voor hetzelfde product openen. Als ze daartoe gedwongen worden, zou de productie zeer inefficiënt worden en dus heel
duur. Als de samenleving betaalbare medicijnen en medische apparatuur eist moet de productie plaatsvinden op de beste locatie tegen de laagst mogelijke kosten. En daarbij moet ook knowhow meetellen.
Maar als elk land barrières gaat opwerpen om de eigen bevolking te beschermen, zullen landen zich gedwongen voelen toch zelf medicijnen te produceren en de werkzame ingrediënten veilig te stellen.
In de mondialiseringsgolf van de afgelopen decennia, zo wordt nu pijnlijk duidelijk, heeft de medicijnenproductie zich verplaatst naar lagelonenlanden. Doel was de zorg toegankelijk te houden door
kostenbeperking.
De prijs van een antibioticakuur is bepaald op 2,50 euro. ‘Dat is minder dan een pakje kauwgum. Dat lukt alleen als je dat ver van huis laat produceren en met een container naar Rotterdam laat verschepen’,
zei voorzitter Jean Hermans van de Bogin – de club van generieke medicijnproducenten – vorige week in de Volkskrant.
Maar als landen als China of India in een lockdown raken stagneert de aanvoer. En als er dan ook nog exportverbonden worden afgekondigd – India heeft dat al voor 26 medicijnen gedaan – kunnen er tekorten
ontstaan. Nu blijkt dat nog niet, omdat de aanvoerlijn van de productie van de werkzame bestanddelen in een regio in China, via het draaien van de eigenlijke pillen in India tot het afleveren in een Nederlandse apotheek zes maanden kan duren. Als de keten in het begin wordt verstoord, is dat hier veel later merkbaar.
Voor medicijnen waar de vraag naar is geëscaleerd, zoals het op de ic’s gebruikte propofol, zijn nu al tekorten. ‘De tranen staan in mijn ogen als ik hoor wat er nu op de ic’s in ziekenhuizen gebeurt’, aldus
de hoofdapotheker van Erasmus MC.
Nederland kan nooit op eigen houtje een land als India dwingen voorraden ter beschikking te stellen. In zo’n spel winnen alleen de machtigen. Op Europese schaal kan niet alleen een vuist worden gemaakt, maar kunnen ook strategische voorraden worden aangelegd, en kan gekeken worden of dit continent voor essentiële medicijnen zelf reservecapaciteit moet hebben.
Pandemieën maken de noodzaak van Europese samenwerking meer dan ooit duidelijk.
Radio 1, 5 april 2020
Voorraden om medicijntekorten op te lossen, komen er niet
Klik hier voor de interviews.
Als je een medicijn nodig hebt, en het is er, dan kun je leven. Als dat medicijn er niet is, lever je kwaliteit van leven in. Maar medicijntekorten bestaan al heel lang en patiënten hebben daar serieus last van. Sinds 2018 is de oplossing bekend, namelijk het aanleggen van voorraden. Alleen die medicijnvoorraden zijn er niet gekomen. En door de coronacrisis neemt het tekort van een aantal medicijnen sterk toe.
Door de coronacrisis is er extra vraag naar antibiotica, inhalatiemiddelen en pijnbestrijding. Sommige van die middelen worden behalve in de ziekenhuizen ook voorgeschreven door de huisarts, waardoor de tekorten in totaal oplopen. Daarnaast ‘hamsteren’ mensen. Ze zijn ongerust over een eventuele lockdown en gaan sneller naar de apotheek voor een herhaalrecept.
IJzeren voorraad
Sinds 2013 wordt er overlegd hoe tekorten te verhelpen. Begin dit jaar bleek uit het jaarlijkse overzicht van de apothekersvereniging KNMP dat het aantal meldingen (1492) van tekorten in 2019 verdubbeld was ten opzichte van het jaar ervoor (769). De farmaceutische groothandels hadden echter al in 2018 geconcludeerd dat met een ‘ijzeren voorraad’ van 4 maanden, 75% van de medicijntekorten zou zijn opgelost. De vraag is wat die voorraden in deze coronacrisis hadden kunnen betekenen.
Toen minister Bruins op 3 november 2019 eindelijk verplichte voorraden aankondigde, bleef onduidelijk wie die voorraden moest betalen. Wat is er na die aankondiging eigenlijk gebeurd? (luister interview hier)
Onaantrekkelijk
In Nederland zijn de prijzen voor medicijnen die we het vaakst (75%) gebruiken, de generieke geneesmiddelen waar geen patent meer op rust, heel laag. Een doosje van een generiek geneesmiddel zoals een maagzuurremmer of bloeddrukverlager kost minder dan een pakje kauwgom. Er is dus over de financiering van de geneesmiddelenvoorraden nog geen knoop doorgehakt. Daarnaast hangt fabrikanten en groothandels tal van regelingen boven het hoofd die het niet vanzelfsprekend maken dat er voorraden komen.
Vooruitzicht
Wim Groot, hoogleraar Gezondheidseconomie Maastricht University: "Het voorraden plan dat minister Bruins had, zal er niet komen. Als we dat echt willen, zal het kabinet daar de portemonnee voor moeten trekken. Tot die tijd zullen we moeten leren leven met leveringsproblemen van bepaalde geneesmiddelen.
Volkskrant.nl, 2 april 2020
Medicijnen dreigen over paar maanden op te raken door afhankelijkheid China en India
Basismedicijnen als antibiotica, paracetamol en ibuprofen dreigen binnen enkele maanden op te raken in Europa en de VS. Veel van deze medicijnen, of bestanddelen ervan, worden alleen nog in China of India gemaakt. Maar door de coronacrisis stokt de toelevering. Zo heeft India een exportverbod afgekondigd voor 26 medicijnen en ingrediënten van medicijnen. De export vanuit China stokt eveneens door de corona-epidemie. Bogin, de belangenvereniging van de biosimilars en generieke geneesmiddelenindustrie Nederland, waarschuwt voor een tekort in of na de zomer.
De productie van veel geneesmiddelen is, vanwege de prijsdruk in de afgelopen decennia, overgeheveld naar Aziatische landen. Daar zijn de loonkosten lager en de milieuregels voor chemische bedrijven minder strikt. Bogin-voorzitter Jean Hermans noemt het voorbeeld van een antibioticakuur.
‘Goedkoper dan kauwgum’
‘De kosten daarvan moeten omlaag naar 2,50 euro. Dat is minder dan een pakje kauwgum. Dat lukt alleen als je dat ver van huis laat produceren en met een container naar Rotterdam laat verschepen.’
Wanneer de tekorten exact ontstaan, durft Geo Aldershof, directeur van BG Pharma, de bond van de farmaceutische groothandelaren, nog niet te zeggen. ‘Er zit nog wat in de supplychain. Maar als er niets meer in de voorkant wordt gestopt, komt er direct ook niets uit de achterkant.
En zelfs als de voorkant direct wel weer wordt bevoorraad, kan het een tijd een tijd duren voordat die producten hier bij de apotheek zijn.‘
Volgens Hermans moeten generieke medicijnen zoals paracetamol en antibiotica zes maanden van tevoren worden besteld voordat ze nodig zijn. ‘Daarom is er nu nog geen tekort. Maar als je iets voor over drie weken wilt bestellen, dan is het niet te krijgen.’
Bizar vindt hij het dat in de haven van Rotterdam wel strategische reserves voor olie en andere energiebronnen zijn opgeslagen, maar niet voor medicijnen. ‘Daar hebben we eigenlijk nooit aan gedacht in de multilaterale wereld. Maar in een pandemie is het ineens een achilleshiel.’
China overheerst de markten voor penicilline, antibiotica en andere medicijnen. Chinese bedrijven hebben 90 procent van de markt voor de werkzame bestanddelen, de zogenoemde api’s (active pharmaceutical
ingredients) van antibiotica, vitamine C en ibuprofen in handen. China lijkt de export van farmaceutische producten niet te blokkeren, maar door allerlei restricties in de eigen productie en distributie kunnen er nu toch tekorten in andere landen ontstaan.
Bouw een penicillinefabriek
Vooral voor de bestanddelen van antibiotica is Europa te afhankelijk geworden van China, stelt adviesbureau Roland Berger. In Europa zou een nieuwe fabriek voor de productie van penicilline een investering tussen een half miljard en miljard vergen, ook omdat die moet voldoen aan strenge normen. Die zou bijna een exclusief recht moeten krijgen om voor de hele Europese markt te produceren, omdat het anders niet rendabel is.
Peter Navarro, de handelsadviseur van de Amerikaanse president Donald Trump, stelde eerder dat China het aanbod in de mondiale farmacie naar zich toe heeft weten te trekken ‘door dezelfde oneerlijke handelspraktijken te gebruiken als in de rest van de sectoren: goedkope arbeid, weinig milieuregels en enorme overheidssubsidiëring’.
NRC Handelsblad, 27 februari 2020
Hoelang voordat de pillen op zijn?
Medicijnvoorraad De wereld haalt veel van de grondstoffen voor medicijnen uit China. Wat als deze fabrieken door het coronavirus gesloten blijven?
De productie van verschillende medicijnen in fabrieken in Nantong City, China. China is ’s werelds grootste producent van grondstoffen voor geneesmiddelen. Medewerkers van de Ofichem Groep, een internationale ontwikkelaar en distributeur van farmaceutische ingrediënten, zitten thuis. Ze werken normaal op een inkoopkantoor in de Chinese provincie Zhejiang, maar „mogen nu een keer per twee dagen een uur of drie naar buiten om boodschappen te doen”, zegt hun baas Weite Oldenziel, vanuit het hoofdkantoor in Groningen.
In de schaduw van de directe gevolgen van het coronavirus, sluimert een ander probleem. China is ’s werelds grootste producent van grondstoffen voor geneesmiddelen. In de door het virus getroffen provincies Hubei (met hoofdstad Wuhan) en Zhejiang zijn meer dan honderd productiefaciliteiten voor de geneesmiddelenindustrie, waarschuwen farmaceuten.
De Verenigde Staten bijvoorbeeld, halen 70 tot 80 procent van de grondstoffen voor medicijnen uit China en India, waarvan het leeuwendeel uit China, schatten gezondheidsexperts tegenover persbureau Reuters. Ook van in Nederland gebruikte medicijnen komen veel grondstoffen uit China, bevestigt het ministerie van Volksgezondheid. India, waar grote farmaceuten fabrieken hebben staan, is volgens The Financial Times voor 70 procent afhankelijk van China voor de productie van grondstoffen voor medicijnen.
„Als deze situatie voortduurt, kunnen we niet uitsluiten dat de impact op medicijnvoorraden groot zal zijn”, aldus Medicines for Europe, de Europese belangenclub voor fabrikanten van patentloze medicijnen. Toezichthouders zien het risico ook. Het Europees Medicijnagentschap schrijft dat het virus potentieel kan leiden tot wereldwijde extra tekorten. En een vertegenwoordiger van de Amerikaanse Food and Drug Administration liet aan nieuwszender CNN weten zich „er terdege van bewust te zijn dat de uitbraak waarschijnlijk gevolgen zal hebben voor de toeleveringsketen van medische producten, inclusief mogelijke tekorten van belangrijke medische producten in de VS.”
.jpg)
Eén ding is zeker: het probleem is nog ver van huis. Fabrikanten bestellen grondstoffen zo’n acht maanden van tevoren, juist omdat de aanvoerlijnen uit Azië zo lang zijn. Daarnaast is het „heel moeilijk te achterhalen waar tekorten kunnen ontstaan”, zegt Erin Fox, expert in medicijntekorten bij de Amerikaanse University of Utah. „Farmaceuten mogen bijna alles rond hun productie geheimhouden, zoals de specifieke fabriek, grondstof en zelfs het bedrijf dat het medicijn maakt.”
Tekenen van onrust
Naast onduidelijkheid, zijn er wel al tekenen van onrust. Het Indiase farmabedrijf Cipla waarschuwde dat veel bedrijven „eind deze maand door hun voorraden kunnen raken als Chinese fabrieken hun lichten uit houden”. Het farmabedrijf Overseas Healthcare liet weten dat de prijs van azithromycine en andere antibiotica met de helft is gestegen sinds de uitbraak in januari. Ondernemer Oldenziel zegt dat zijn bedrijf het prijsopdrijvende effect ook merkt bij antibiotica. „Prijzen gaan enorm de lucht in. Er is onrust op de markt.”
Die onrust bereikt ook de Indiase overheid. The Times of India meldde dat een door de overheid aangesteld expertcomité adviseert om exportrestricties te overwegen voor twaalf medicijnen: verschillende antibiotica, vitamine B1, B2 en B6 en het hormoon progesteron. „We begrijpen dat er genoeg voorraad is voor minstens twee maanden”, zegt een lid van het comité tegen de krant, maar „aangezien de provincies Hubei en Shandong verantwoordelijk zijn voor 20 tot 25 procent van de grondstoffen, kan er een sneeuwbaleffect ontstaan als de problemen aanhouden”.
Ondanks deze slechte voortekenen, ziet Jan Burger, inkoopspecialist van actieve grondstoffen voor medicijnen bij 4Pharma & Health, nog lang geen reden tot paniek. „Farmaceuten hebben veiligheidsvoorraden van minimaal drie maanden. Er zijn er genoeg die een jaar voorraad van hun belangrijkste producten hebben. Pas als fabrieken nog maanden dichtblijven, wordt het riskant.”
Dat er nog geen acuut probleem is, denkt ook Jean Hermans van Bogin, de Nederlandse koepelorganisatie voor fabrikanten van patentloze geneesmiddelen. „Ziekenhuizen vragen al aan farmaceuten hoe lang zij nog kunnen leveren. Er is nu nog geen probleem, maar wel als dit veel langer duurt.”
De productie van verschillende medicijnen in fabrieken in Nantong City, China. China is ’s werelds grootste producent van grondstoffen voor geneesmiddelen. Leveranciers maken zich wel al zorgen, zegt Ludwig Castelijns, voorman van Mosadex, de grootste medicijngroothandel in Nederland. „Zeker als dit aanhoudt. De gevolgen nemen exponentieel toe als de sluiting van fabrieken vier, vijf, of zes maanden duurt. En de gevolgen van het virus kunnen een jaar, misschien zelfs twee doorwerken.”
Duidelijk is wel dat farmaceuten een gelukje hebben gehad. Chinees Nieuwjaar was voor de verspreiding van het virus desastreus, maar zorgde er wel voor dat farmaceuten vooraf rekening hielden met een productiestop. Oldenziel van de Ofichem Groep: „Chinees Nieuwjaar duurt elk jaar een beetje langer door de toegenomen welvaart, dus we hadden al 2,5 week extra aan producten ingekocht.”
Liever innovatieve kankermedicijnen
Het fenomeen van medicijntekorten en een kwetsbare productieketen is niet nieuw. Vorig jaar waren bijna 1500 geneesmiddelen in Nederland meer dan twee weken niet leverbaar, een record. Minister Bruno Bruins (VVD, Medische Zorg) wijst in antwoorden op Kamervragen vaak naar de afhankelijkheid van met name China en India. Doordat medicijnen uit steeds minder fabrieken komen, hebben fouten zoals een afgekeurde partij of calamiteit in een fabriek wereldwijde gevolgen.
Dat is niet altijd zo geweest. Geneesmiddelentekorten waren in de jaren negentig nog zeldzaam. Fabrieken stonden nog met name in landen als de Verenigde Staten, Zwitserland, Duitsland en het Verenigd Koninkrijk. Vanaf begin 21ste eeuw is een groot deel van de productie verplaatst naar lagelonenlanden, veelal China en India. „Bij medicijnen waar geen patent meer op rust, is er een race to the bottom geweest”, zegt Hermans van farmabelangengroep Bogin. „Bedrijven kunnen alleen nog aan de lage kostprijs voldoen als ze de productie outsourcen naar landen als India en Pakistan.”
Bij problemen in de productie staat Nederland volgens het RIVM „achteraan in de rij”
Een treffend voorbeeld is het antibioticum Benzathine benzylpenicilline (BGP). Omdat daar geen patent op rust, is er niet zoveel winst meer mee te maken. Bedrijven stortten zich liever op innovatieve nieuwe kankermedicijnen. Farmareuzen als AstraZeneca en Eli Lilly zijn dan ook gestopt met het produceren van antibiotica. De grondstof van BGP wordt nog maar in vier fabrieken gemaakt: één in Europa en drie in Zuidoost-China, zo blijk uit een onderzoeksrapport van de stichting Access to Medicine. Momenteel is er in ongeveer veertig landen een tekort aan dit middel.
Al in 2001 verschijnt er een artikel in The British Medical Journal over een alarmerende toename van geneesmiddelentekorten in Amerikaanse ziekenhuizen. Het Nederlandse ministerie van Volksgezondheid begint in 2013 met een werkgroep die het probleem moet bestrijden. Afgelopen jaren zijn er op Nederlands en Europees niveau tientallen maatregelen genomen - resoluties, meldpunten, conferenties, voorstellen, task forces, pamfletten en handleidingen, etcetera - maar het probleem blijft groeien. Het Rijksinstituut voor Volksgezondheid en Milieu (RIVM) merkt in een rapport droogjes op dat „de geleverde inspanningen van overheid, bedrijven en zorgverleners” tegen tekorten „veel tijd en geld kosten”, maar „nauwelijks bijdragen aan het voorkomen en ontstaan van tekorten”. Momenteel lopen er onderhandelingen met het ministerie, groothandelaren en zorgverzekeraars over wie de extra voorraden gaat betalen om de ergste problemen met tekorten op te lossen.
Patentloze medicijnen in Nederland
Nederland heeft extra veel last van de tekorten. In 2014 bleek uit onderzoek van de Europese Associatie van ziekenhuislaboratoria dat Nederland, Denemarken, Portugal en Kroatië verhoudingsgewijs de meeste tekorten hebben. Farmaceuten wijzen als oorzaak naar de lage prijzen die in Nederland worden betaald voor patentloze medicijnen. Minister Bruno Bruins (Medische Zorg, VVD) erkende eerder in een Kamerbrief dat de prijzen voor geneesmiddelen waarvoor concurrentie bestaat, in Nederland verhoudingsgewijs laag zijn. Als er problemen in de wereldwijde productie ontstaan, staat Nederland volgens het RIVM „achteraan in de rij”. Daarbij werken de Nederlandse volumes niet mee: een land als Frankrijk kan veel grotere bestellingen doen.
„Als er schaarste ontstaat door corona, kijken leveranciers wie de beste klanten zijn”, zegt Castelijns van Mosadex. „Nederland is dat niet.” Hermans sluit zich daarbij aan: „Moeten we niet wat soepeler zijn in ons prijsbeleid als corona echt invloed krijgt op de geneesmiddelenproductie?”
27 februari 2020, Financieel Dagblad
Medicijntekort door coronavirus kan Nederland hard raken
Door het stilvallen van geneesmiddelenfabrieken in China worden tekorten aan medicijnen verwacht. Als schaarste ontstaat, is de kans groot dat Nederland door zijn lageprijzenbeleid achteraan in de rij staat. Fabrikanten pleiten voor een flexibel prijs- en toelatingsbeleid voor medicijnen.
Productie van medicijnen in de farmaceutische fabriek van Lupin Ltd. in Salcette, Goa, India. In China staan honderden fabrieken die grondstoffen voor medicijnen maken. Zij leveren aan fabrieken in India die geneesmiddelen produceren voor de hele wereld.
Productie van medicijnen in de farmaceutische fabriek van Lupin Ltd. in Salcette, Goa, India. In China staan honderden fabrieken die grondstoffen voor medicijnen maken. Zij leveren aan fabrieken in India die geneesmiddelen produceren voor de hele wereld.
In het kort
De uitbraak van het coronavirus in China raakt ook fabrieken van medicijnengrondstoffen.Door het stilvallen van productie wordt over een aantal maanden schaarste verwacht.Vanwege het lageprijzenbeleid is Nederland kwetsbaar als er tekorten in de markt ontstaan.
In de door het coronavirus getroffen Chinese provincies staan honderden fabrieken die grondstoffen voor medicijnen maken. Zij leveren aan fabrieken in India die geneesmiddelen produceren voor de hele wereld. Verschillende internationale organisaties hebben gewaarschuwd voor de gevolgen van het stilvallen van de Chinese productie. Zo vrezen de brancheverenigingen van Europese en Amerikaanse fabrikanten van medicijnengrondstoffen dat de tekorten waar veel landen nu al mee kampen, zullen verergeren. Het gaat vooral om generieke medicijnen die relatief goedkoop zijn en die al uit patent zijn gelopen.
Dat is op dit moment overigens nog niet merkbaar, blijkt uit een rondgang van het FD langs groothandels, farmaceuten, brancheverenigingen en het Europese Geneesmiddelenagentschap (EMA). Niet zo gek, want de levertijd van veel medicijnen is tussen de zes en negen maanden. Pas over een klein halfjaar zullen de eerste gevolgen merkbaar zijn, is de verwachting. Het is nog onduidelijk hoe groot die gevolgen zijn en voor welke middelen ze gelden.
Hogere prijzen
De meeste marktpartijen verwachten wel dat schaarste de prijzen van bepaalde middelen zal opdrijven. En dat kan nadelig zijn voor Nederland, zegt voorzitter Jean Hermans van Bogin, de belangenorganisatie van fabrikanten van generieke geneesmiddelen. 'Wij hebben zeer lage prijzen in Nederland en die kunnen door wet- en regelgeving niet omhoog. Als de markt vecht om beschikbare middelen zijn wij als laatste aan de beurt.'
Hij pleit daarom voor flexibiliteit vanuit het ministerie en zorgverzekeraars. ‘Dat moeten we samen oplossen en daar mag de patiënt niet de dupe van zijn.'
Ongerustheid
In Nederland betalen we gemiddeld minder dan €2 voor een doosje geneesmiddelen, zegt Hermans. 'Als die de prijs naar €2,80 gaat, dan moeten we maar even €2,80 betalen en niet vasthouden aan die lage prijs.' Hij benadrukt wel dat er op dit moment nog geen reden is voor ongerustheid.
Vorig jaar was in Nederland aan bijna 1500 geneesmiddelen een tekort, blijkt uit een inventarisatie van apothekersbranchevereniging KNMP. Dat is een verdubbeling ten opzichte van 2018. Problemen met productie of kwaliteit liggen ten grondslag aan de almaar oplopende geneesmiddelentekorten, zegt KNMP, maar ook economische redenen spelen een rol. 'Zodra de productie na een tekort weer op gang komt, staat Nederland achteraan de rij. Ons land is door de lage prijzen voor fabrikanten en het beperkte inwoneraantal geen aantrekkelijk afzetgebied.'
Snellere toegang
De Europese branchevereniging van fabrikanten Medicines for Europe waarschuwt in een brief aan de Europese Commissie dat door prijsbeleid een 'onhoudbare marktsituatie' kan ontstaan. Ze wijst erop dat fabrikanten volgens de wet medicijnen niet met verlies mogen verkopen, wat een probleem kan worden als landen prijsplafonds hebben.
Ook kunnen ziekenhuizen problemen krijgen als de vergoeding van de zorgverzekeraars voor een medicijn lager ligt dan de prijs. De branchevereniging vraagt de Commissie om flexibiliteit en het versneld toelaten van medicijnen of grondstoffen die nog niet geregistreerd zijn.
De problemen vanwege het coronavirus voeden de discussie om medicijnproductie terug naar Europa te halen. Politici en farmaceuten maken zich in toenemende mate zorgen dat Europa voor zijn medicijnvoorziening te afhankelijk is geworden van India en China.
Het ministerie van VWS was ondanks herhaaldelijke verzoeken niet bereikbaar voor commentaar.
23 januari 2020, Pharmaceutisch Weekblad
Biosimilars: goed en goedkoper alternatief
Biosimilars zijn een kwalitatief gelijkwaardig maar goedkoper alternatief voor originele biologische middelen. Hierdoor kon in 2018 € 150 miljoen worden bespaard ten opzichte van 2014 en konden bijna 25% meer patiënten worden behandeld met deze middelen. Dit blijkt uit eerste resultaten van het programma Biosimilars op Maat (BOM).
De introductie van biosimilars zorgt ook voor meer marktwerking. Daardoor dalen de prijzen van gelijkwaardige middelen, maar ook van andere geneesmiddelen binnen hetzelfde indicatiegebied. Zo daalden de prijzen van drie TNF-alfaremmers (adalimumab, certolizumab pegol en golimumab) waarvoor in 2018 nog geen biosimilar beschikbaar was met 13 tot 20%. Volgens de BOM-onderzoekers probeerde de producent van Humira zijn marktaandeel te consolideren met langlopende contracten, om te voorkomen dat door toekomstige inzet van biosimilars fors marktaandeel verloren zou gaan.
BOM is een initiatief van Biosimilars Nederland en het Instituut Verantwoord Medicijngebruik, uitgevoerd in opdracht van het ministerie van VWS. Het programma loopt van februari 2018 tot en met juni 2020; deze resultaten zijn een tussenstand.
Goede argumenten
“Biosimilars dragen ook breder bij aan een betere betaalbaarheid van geneesmiddelen”, zegt Arnold Vulto, voorzitter van Biosimilars Nederland. “Dat is goed nieuws aan het begin van het jaar, dat ook wel eens verteld mag worden, want veel professionals in de zorg hebben zich hiervoor ingespannen.”
Volgens Vulto zorgt BOM voor meer kennis over biosimilars, waardoor het draagvlak onder zorgverleners om deze middelen in te zetten wordt vergroot. “Ze kunnen hun voorschrijf- en keuzebeleid nu van goede kennis en argumenten voorzien”, meent Vulto. “Zo draagt het BOM-programma bij aan kostendalingen en gunstige marktontwikkelingen voor biologische geneesmiddelen in Nederland.”
Flinke besparing
Dat biosimilars leiden tot een flinke besparing bewijzen onder meer de TNF-alfaremmers etanercept en infliximab. In 2014 werd aan beide middelen € 310 miljoen uitgegeven, door de komst van biosimilars in 2015/2016 daalde dat bedrag met € 109 miljoen naar € 201 miljoen in 2018. Per patiënt betekende dit een besparing van 44% voor etanercept (van € 10.932 naar € 6134) en 50% voor infliximab (van € 15.425 naar € 7698).
Binnen de oncologie/hematologie gingen de uitgaven van rituximab omlaag van € 62 miljoen (2014) naar € 45 miljoen (2018). Per patiënt betekende dit een daling van € 8751 naar € 4929 per jaar. Vulto concludeert dat van de vijf biosimilar-beloftes uit 2013 er vier zijn waargemaakt in de afgelopen vijf jaar: biosimilars zijn een goedkoper alternatief; daardoor dalen ook de kosten van andere middelen in een bepaalde therapeutische categorie; meer patiënten kunnen worden behandeld binnen het budget en er komt geld vrij voor nieuwe – dure – innovaties. Alleen de vijfde belofte – door gunstigere kosteneffectiviteit van biosimilars kunnen patiënten eerder toegang krijgen tot deze voorheen voor sommige indicaties/behandeltrajecten te dure middelen – kon niet voldoende worden aangetoond. Vulto: “Hiervoor is nader onderzoek nodig.”
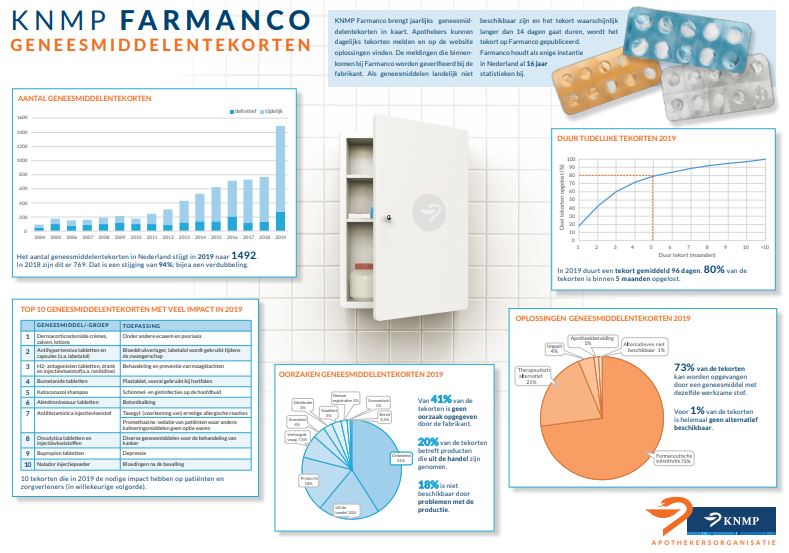
Persbericht KNMP 20 januari 2020
Geneesmiddelentekorten in 2019 verdubbeld
Het aantal geneesmiddelentekorten in Nederland is in 2019 nagenoeg verdubbeld. De tekorten liepen vorig jaar op naar 1492, tegenover 769 in 2018. Dit blijkt uit een inventarisatie door KNMP Farmanco. ‘Het zijn duidelijke cijfers’, stelt voorzitter Aris Prins van de apothekersorganisatie KNMP vast. ‘Patiënten, apothekers en andere zorgverleners hebben hier dagelijks enorme hinder van.’
In het oog springende tekorten in 2019 waren onder meer crèmes, zalven en lotions voor huidaandoeningen, bloeddrukverlagers en geneesmiddelen voor behandeling van maagklachten, zoals ranitidine. Deze worden door grote patiëntengroepen gebruikt.
De almaar oplopende geneesmiddelentekorten hebben diverse oorzaken. In de keten kunnen er problemen zijn met productie, distributie en kwaliteit. Ook zijn er economische redenen aan de orde. Zodra de productie na een tekort weer op gang komt, staat Nederland achteraan de rij. Ons land is door de lage prijzen voor fabrikanten en het beperkte inwoneraantal geen aantrekkelijk afzetgebied.
De KNMP stelt een aantal oplossingsrichtingen voor. De apothekersorganisatie omarmde vorig jaar al het plan van de minister van VWS om ijzeren voorraden aan te leggen. Voorts is de KNMP er een voorstander van de productie van geneesmiddelen terug te halen naar Europa. ‘In beide gevallen vergt dat investeringen’, weet voorzitter Prins. ‘En het kost ook tijd. Het aanleggen van ijzeren voorraden kan binnen een paar jaar worden geregeld. Het produceren in Europa vraagt om meer geduld. De beweging richting China en India werd eveneens niet op een dag gemaakt. We zijn nu erg afhankelijk geworden van deze verre landen.’ Een derde optie is wat betreft de KNMP een modernisering van het inkoopbeleid. ‘Als de prijzen eenmaal zo laag zijn, en dat zijn ze nu, kunnen meerdere middelen voor langere tijd als preferent worden aangewezen.’
Dat geeft de apotheker in de praktijk ook meer armslag, stelt Prins vast. ‘Het is onze taak goede farmaceutische zorg te leveren. Als de voorschrijver een werkzame stof aanwijst, kan de apotheker daar als medicatiespecialist heel goed de juiste middelen bij vinden. Zelfs in 2019 zijn we er bijna altijd in geslaagd de patiënt van medicatie te voorzien. Dat hebben we te danken aan het hoge niveau van de farmaceutische zorg in Nederland, we behoren tot de wereldtop.’
Voor de apothekersorganisatie brengt KNMP Farmanco de geneesmiddelentekorten in kaart. Indien een geneesmiddel landelijk niet verkrijgbaar is, gedurende minimaal veertien dagen, noteert KNMP Farmanco een nieuw tekort voor het jaarlijkse overzicht. Meldingen door apothekers worden geverifieerd bij de fabrikanten. Farmanco houdt al zestien jaar statistieken bij over geneesmiddelentekorten in Nederland.
Klik hier voor de vergrote infographic.
Medische Oncologie, juni 2019
‘Met biosimilars kunnen internist-oncologen jaarlijks 100 miljoen euro besparen’
Dr. Anton Franken
In de reumatologie, gastro-enterologie en endocrinologie worden biosimilars al jaren toegepast en ook in de oncologie groeit het aantal biosimilars. Toepassing ervan kan de zorgkosten terugdringen, waardoor budgettaire ruimte ontstaat voor nieuwe middelen. Het is de verantwoordelijkheid van de internist-oncoloog om zich goed te informeren over de optimale inzet van biosimilars en deze waar mogelijk voor te schrijven. Met de biosimilars die al beschikbaar zijn of in de komende twee jaar beschikbaar komen, kunnen internist-oncologen een besparing van 100 miljoen euro per jaar realiseren. In een tijd waarin veel wordt gediscussieerd over dure geneesmiddelen, kunnen we als internisten een belangrijke bijdrage leveren door waar mogelijk biosimilars in te zetten.
Stichting Initiatiefgroep Biosimilars Nederland en Instituut voor Verantwoord Medicijngebruik ontwikkelden met een subsidie van het ministerie van VWS het programma Implementatie Biosimilars op Maat in ziekenhuizen (BOM). BOM richt zich op de gehele breedte van de (interne) geneeskunde. BOM beschikt over een breed pakket aan materialen, waaronder animatiefilms, e-learning, trainingen, factsheets en voorlichtingsmateriaal voor patiënten. Het programma bevat modules voor alle beroepsgroepen die in een ziekenhuis te maken hebben met de omzetting naar biosimilars: artsen, verpleegkundigen, apothekers, apothekersassistenten. Door alle stakeholders erbij te betrekken, willen we dat alle betrokkenen, met name ook de patiënten, goed geïnformeerde keuzes maken rond de inzet van biosimilars.
Een fysieke scholing over motiverende gesprekstechnieken en gedeelde besluitvorming is mede in samenwerking met het Erasmus MC ontwikkeld om hierin te ondersteunen. In de top 20 van duurste geneesmiddelen (alle biologicals) staan verscheidene oncolytica. Drie belangrijke dure middelen zijn al uit patent of gaan binnenkort uit patent. Trastuzumab en rituximab zijn al als biosimilar beschikbaar. Binnen twee jaar komt ook de al geregistreerde biosimilar voor bevacizumab beschikbaar; deze moet wachten tot het patent op het originele middel verlopen is. Naast oncolytica zijn ook voor andere in de oncologie gebruikte middelen, zoals filgastrim en pegfilgastrim, verscheidene biosimilars beschikbaar. De transitie naar biosimilars verloopt soms bijzonder goed.
Een schoolvoorbeeld is de toepassing van rituximab in de hematologie, waarbij de beroepsgroep het voortouw nam en de richtlijn aanpaste ten voordele van de biosimilar. Landelijk wordt nu meer dan 90 procent van de patiënten bij wie rituximab is geïndiceerd behandeld met de biosimilar. Bij trastuzumab is ook al veel bereikt; in ongeveer de helft van alle gevallen waarin dit middel wordt ingezet, krijgt de patiënt een biosimilar. Bij trastuzumab wordt het overzetten op de biosimilar soms nog bemoeilijkt door het gegeven dat het originele middel inmiddels ook in subcutane formulering beschikbaar is. Desondanks zetten veel ziekenhuizen in op behandeling met de biosimilar, waarbij soms zelfs patiënten thuis een infuus krijgen.
De prijs van het originele middel is overigens, vermoedelijk als gevolg van marktwerking, al flink gedaald. De ervaringen die in de afgelopen jaren zijn opgedaan binnen de reumatologie en andere gebieden laten zien dat het actief stimuleren van biosimilars een gunstig effect heeft op de zorg. In de reumatologie groeit bijvoorbeeld dankzij de inzet van (betaalbare) biosimilars het aantal patiënten dat wordt behandeld met geavanceerde behandelingen (biologicals) – ook in een eerder stadium van hun ziekte. In situaties waarin verscheidene biosimilars beschikbaar zijn, zoals bij pegfilgastrim, kiezen zorgverzekeraars soms voor één specifieke variant. Zo’n preferentiebeleid draagt bij aan de kostenbesparing, maar het nadeel is dat de zorgverzekeraar daarmee op de stoel van de voorschrijver gaat zitten. In het geval van pegfilgastrim speelt bovendien de mogelijke voorkeur van de patiënt voor een device (pen) mee. Wij vinden het daarom belangrijk dat zorgverzekeraars in een vroeg stadium in overleg treden met ziekenhuizen, behandelaars en patiënten, om voor iedereen een winwinsituatie te creëren (gainsharing).
Het BOM-programma is er overigens niet op gericht om koste wat het kost alle patiënten met biosimilars te behandelen, maar om een goed afgewogen keuze te maken op grond van correcte informatie. Uit enquêtes blijkt dat artsen en andere professionals nog niet altijd op de hoogte zijn van alle mogelijkheden en soms nog hun oren laten hangen naar suggestieve informatie van de farmaceutische industrie. Zo lukt het de producenten van de originele middelen soms om twijfel te zaaien over de effectiviteit van biosimilars. De onafhankelijke informatie van BOM kan dan bijdragen aan de broodnodige helderheid.
Dr. Anton Franken
Hij is: internist-endocrinoloog bij Isala in Zwolle. Hij is secretaris van de Stichting Initiatiefgroep Biosimilars Nederland, die samen met het Instituut voor Verantwoord Medicijngebruik het programma Implementatie Biosimilars op Maat in ziekenhuizen (BOM) verzorgt. Hij vindt: dat artsen die dure biologische geneesmiddelen voorschrijven een verantwoordelijkheid hebben om een zorgvuldige en goed geïnformeerde afweging te maken wanneer biosimilars beschikbaar zijn.
Meer informatie: www.biosimilars-nederland.nl of bom@medicijngebruik.nl
augustus 2019, Instituut Verantwoord Medicijngebruik
Inzicht in biosimilargebruik met de Geneesmiddelenmonitor
In het kort
Met de Geneesmiddelenmonitor het gebruik van dure (add-on) geneesmiddelen in uw ziekenhuis analyseren en met andere ziekenhuizen vergelijken. Er kan hierbij dieper ingezoomd worden op de dure geneesmiddelen waarvoor biosimilars op de markt zijn.
De Geneesmiddelenmonitor is door DHD ontwikkeld in samenwerking met de NVZ, NFU en Nederlandse Vereniging voor Ziekenhuisapothekers (NVZA). Met de Geneesmiddelenmonitor kunt u, als ziekenhuismedewerker, het gebruik van dure (add-on) geneesmiddelen in uw ziekenhuis analyseren en met andere ziekenhuizen vergelijken. U kunt hierbij dieper inzoomen op de dure geneesmiddelen waarvoor biosimilars op de markt zijn.
Met de informatie uit de Geneesmiddelenmonitor kunt u bijvoorbeeld:
- uw keuze onderbouwen om wel of niet op een biosimilar over te stappen;
- omzetpercentages bij eerdere omzettingen nagaan, bijvoorbeeld van referentiemiddel naar biosimilar;
- omzettingen op het niveau van specialisme, aandoening of indicatie monitoren;
- van uw eigen ziekenhuis alle verstrekkingen per patiënt inzien.
De informatie uit de Geneesmiddelenmonitor is gebaseerd op de data die de Nederlandse ziekenhuizen aanleveren aan de Landelijke Basisregistratie Ziekenhuiszorg (LBZ) en heeft een landelijke dekking.
Programma Biosimilars op Maat (BOM) en de Geneesmiddelenmonitor
Het IVM heeft in samenwerking met de Initiatiefgroep Biosimilars Nederland (IBN), met subsidie van VWS, het programma Implementatie Biosimilars op Maat in ziekenhuizen (BOM) ontwikkeld. Dit programma ondersteunt ziekenhuizen en umc’s bij lokale vraagstukken op het gebied van beleid en implementatie van biosimilars. Denk hierbij aan het creëren van meer draagvlak bij voorschrijvers, communicatie richting patiënten en aspecten rondom keuzes bij inkoop.
Binnen het BOM-programma is de Geneesmiddelenmonitor een van de middelen die inzicht bieden bij deze lokale vraagstukken. Om de toepassing voor gebruikers verder te vergroten, staat in de samenwerking tussen het IVM en DHD de doorontwikkeling en het praktisch gebruik van de Geneesmiddelenmonitor centraal. Dit najaar komt bijvoorbeeld een nieuwe benchmark met informatie over start- en switchgedrag beschikbaar, waarin u onder andere kunt zien of patiënten geswitcht zijn naar biosimilars en of dit overeenkomt met of afwijkt van uw peergroup. Via de werkgroep Geneesmiddelenmonitor wordt de samenwerking verder vormgegeven.
Aan de slag met de Geneesmiddelenmonitor
De Geneesmiddelenmonitor is beschikbaar voor alle medewerkers van ziekenhuizen die zijn aangesloten bij de NVZ en NFU. Op de website van DHD leest u hoe u eenvoudig toegang kunt aanvragen. Het IVM kan u vervolgens ondersteunen bij het duiden van uw analyses en het terugkoppelen van de resultaten naar bestuurders, voorschrijvers, financials en andere stakeholders binnen het ziekenhuis.
Meer informatie
Op deze pagina vindt u meer informatie over de Geneesmiddelenmonitor. Ook kunt u de brochure Geneesmiddelenmonitor downloaden.
Informatie over het BOM-programma vindt u op www.biosimilar.nl.
Voor hulp bij duiding kunt u een e-mail sturen naar het IVM via bom@medicijngebruik.nl of contact opnemen met de projectleider BOM Hans de Vos Burchart via h.vosburchart@medicijngebruik.nl of 0623790349. Meer informatie op www.biosimilar.nl.
de Volkskrant, 27 augustus 2019
Open brief: Farmaceuten, draag steentje bij
Beste farmaceuten, afgelopen week sprongen er voor mij twee berichten uit in de pers. Eén mooi bericht: twee nieuwe belangrijke kankermedicijnen komen in het basispakket. Het tweede verontrustend: de zorgkosten zijn voor steeds meer Nederlanders niet betaalbaar.
Deze twee berichten schetsen in een notendop het dilemma waar wij - en met ons veel andere landen - voor staan in de gezondheidszorg: ja, we zijn blij met nieuwe medicijnen die hoop bieden aan zieke mensen. Daar zijn we jullie farmaceuten dankbaar voor. Maar nee: we kunnen niet accepteren dat de zorgkosten zo ver oplopen dat ze voor mensen niet meer betaalbaar zijn.
Natuurlijk zijn de kostenstijgingen in de zorg niet alleen te wijten aan dure geneesmiddelen. We zijn met meer ouderen, leven langer, zijn vaker chronisch ziek. Maar dure medicijnen slokken een steeds groter deel van het zorgbudget op. Zo stegen de ziekenhuisuitgaven aan dure geneesmiddelen in 2017 met zo'n 10 procent. Op dit moment geven ziekenhuizen ongeveer 2,2 miljard euro uit aan deze geneesmiddelen.
Een behandeling met een prijs van 100 duizend euro per jaar? Allang geen uitzondering meer. En er dienen zich nog veel duurdere medicijnen aan. Neem het middel Zolgensma tegen de spierziekte SMA. Dik 2 miljoen euro. Per patiënt.
Wat mij vooral dwarszit, is dat we niet mogen weten waaróm we zo veel moeten betalen. We krijgen simpelweg geen uitleg, geen inzicht in de prijsopbouw.
Ik vind dat onaanvaardbaar. Kijk eens wat er elders in de zorg gebeurt: overal werken gedreven zorgverleners, bestuurders en patiënten samen met mij om de kosten in de hand te houden. Ik heb met al die partijen afspraken gemaakt die er op neerkomen dat we meer en betere zorg krijgen, maar wel voor minder geld. Dat kan, als we het anders organiseren. Meer zorg in de buurt en thuis, minder in het ziekenhuis. Meer samenwerking, meer e-health, de taken anders verdelen - om maar een paar afspraken te noemen.
Makkelijk is dat niet. Maar onder het motto 'something gotta give' is iedereen bereid over zijn schaduw te springen, wat in te leveren, de status quo te doorbreken. En samen te werken. In het besef dat dit keihard nodig is om de zorg uitvoerbaar en betaalbaar te houden.
Hoe zuur is het dan dat één heel belangrijke partij in de zorg niet of nauwelijks meedoet, te weinig verantwoordelijkheid neemt. Er zelfs vaak een flinke schep bovenop gooit. Niet omdat het moet. Maar omdat het kan.
Beste farmaceuten, miljoenen Nederlanders zijn afhankelijk van medicijnen. Om beter te worden, of als dat niet meer kan, zo lang en goed mogelijk te kunnen leven. Daaraan mag je een goede, zelfs een heel goede boterham verdienen. Maar extreme prijzen, woekerwinsten en een totaal gebrek aan transparantie passen niet bij die belangrijke maatschappelijke positie.
Omdat ik weiger te aanvaarden dat patiënten de dupe worden van deze situatie, voer ik komende weken weer gesprekken met een farmaceutisch bedrijf dat de prijs van een geneesmiddel heeft verhoogd tot ongeveer 150 duizend euro per patiënt per jaar.
Ik zal vragen naar een verklaring voor deze prijsstijging. Komt daar een plausibel verhaal uit - hoge ontwikkelkosten, vele mislukte trajecten die vooraf gingen aan dit ene succes - dan zal ik de fabrikant vragen daarmee in de publiciteit te treden. Een goed verhaal mag immers verteld worden.
Is er geen goed verhaal, dan ga ik me beraden op vervolgstappen. Eén daarvan is het zoeken van publiciteit. Daarom noem ik het bedrijf niet in deze brief. Nog niet.
Begrijp mij goed. Ik heb grote waardering voor de innovatiekracht van uw sector. Uw werk is letterlijk van levensbelang. En er zijn farmabedrijven met vestigingen in Nederland die snappen dat het zo niet verder kan, die ook nadenken over meer transparantie. Maar zij missen de hulp en medewerking van hun moederbedrijven in Frankrijk, Duitsland of de Verenigde Staten.
Daarom werk ik samen met andere landen op dit onderwerp. Maar ik doe hierbij ook rechtstreeks een indringende oproep aan die moederbedrijven en hun aandeelhouders: pak uw maatschappelijke verantwoordelijkheid.
Ook in uw eigen belang. De maatschappelijke druk zal alleen maar toenemen als een gedragsverandering uitblijft. Een voorname Nederlandse investeerder besloot onlangs niet meer te investeren in farma-industrie met onduidelijke prijzen. Volgen er meer?
Ik blijf me intussen met alles wat ik in me heb, inzetten voor onze Nederlandse patiënten, zodat zij de medicijnen krijgen die ze nodig hebben.
Maar ik kan het niet alleen. Ik wacht op een partner die zijn verantwoordelijkheid stevig neemt. Als iedereen bereid is bij te dragen aan betaalbare zorg, dan kan de farma-industrie niet achterblijven. Iets zal er moeten bewegen, something gotta give.
Farmabedrijven moeten hun maatschappelijke verantwoordelijkheid pakken en transparant zijn.
26 juni 2019, SFK/het Pharmaceutisch Weekblad
Nieuwe introducties maken behandeling met generieke middelen gemiddeld duurder
Aandeel merkloze medicijnen in 2018 wederom toegenomen
Opnieuw steeg in 2018 het aandeel van verstrekkingen met generieke middelen. Bijna 78% van alle verstrekkingen door openbare apotheken van receptplichtige geneesmiddelen uit het basispakket, betrof een generiek middel. In 2017 was dat iets minder dan 76%. De kosten van een maand behandelen met een generiek middel namen in 2018 toe tot € 2,88.
Fabrikanten mogen merkloze, generieke geneesmiddelen op de markt brengen als het patent van een spécialitégeneesmiddel is verlopen. Vanwege lagere prijzen komen de kosten van een behandeling met een generieke variant (veel) goedkoper uit dan die met het originele product. Generieke geneesmiddelen maakten in 2018 bijna 78% uit van alle verstrekkingen van receptplichtige geneesmiddelen die verzekeraars vergoeden. Daar staat tegenover dat ze verantwoordelijk zijn voor slechts 20% van de materiaalkosten van alle receptplichtige geneesmiddelen uit het basispakket. Ook dat aandeel is gestegen, want in 2017 was dat nog 18%. Het aandeel van generieke middelen in het totaal van materiaalkosten nam in 2018 verhoudingsgewijs meer toe dan hun aandeel in het totaal aantal verstrekkingen. Dit leidde ertoe, dat generieke medicijnen gemiddeld duurder zijn geworden.
Een behandeling met een generiek middel kostte in 2018 gemiddeld € 2,88 per maand, terwijl dat in 2017 nog € 2,66 was (+8%). Deze stijging wordt vooral veroorzaakt door de introductie van generieke
varianten van naar verhouding dure spécialités. Zo kwam in 2018 cholesterolverlager ezetimib merkloos beschikbaar. Hoewel de prijs van de generieke variant ongeveer twee derde lager is dan die van het spécialité Ezetrol, komt een maandbehandeling met de generieke variant uit op ruim € 13 en van de generieke variant van de combinatie met simvastatine (Inegy) zelfs op ruim € 37. Omdat beide producten in 2018 een aanzienlijke omzet haalden, droegen ze naar verhouding veel bij aan de toename van gemiddelde kosten van generieke middelen.
Overige inkoopkanalen
Bijna 18% van de verstrekkingen van receptplichtige geneesmiddelen uit het basispakket betreft een spécialité. Samen zijn de spécialités verantwoordelijk voor 64% van de geneesmiddelkosten. Gemiddeld kost een behandeling met een spécialité ruim € 31 per maand. Dat is meer dan tien keer zoveel als met een generiek middel. Apothekers verstrekten in 2018 in 97% van de gevallen een generieke variant als die ook beschikbaar was. Dit percentage – de substitutiegraad – is al jaren onverminderd zo hoog. Als een fabrikant een geneesmiddel in een ander Europees land tegen een lagere prijs op de markt brengt dan in Nederland, loont het soms de moeite om dat middel officieel in Nederland te importeren. Dat wordt parallelimport genoemd. Het aandeel dat de materiaalkosten van deze groep middelen uitmaakte van alle kosten, daalde in 2018 met ruim 1%-punt naar 12,1%. Het aandeel dat bereidingen uitmaakte van de verstrekkingen daalde met een vijfde naar 1,4%, terwijl hun kostenaandeel vrijwel onveranderd bleef. 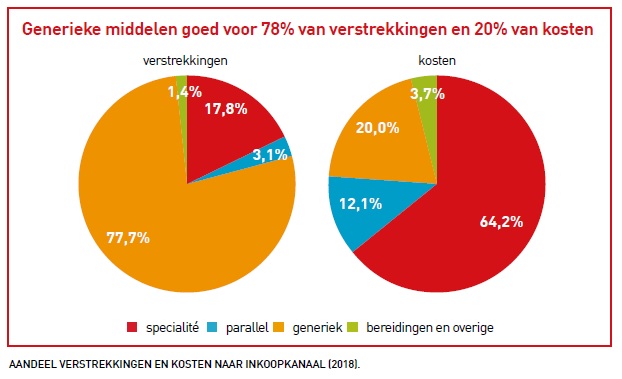
21 maart 2019
Biosimilars op Maat (BOM) in ziekenhuizen
- Materialen en scholingen programma (BOM)
- Factsheet Biosimilars op Maat in ziekenhuizen (BOM)
PW 15 maart 2019
Veilig switchen naar infliximab biosimilars
Het switchen naar biosimilars is onderwerp van discussie: kan dat veilig bij patiënten worden toegepast en vooral bij patiënten met inflammatoire darmaandoeningen (IBD)? Recentelijk zijn twee biosimilars op de markt verschenen voor infliximab (Remicade): Inflectra en Remsima. Binkhorst et al. onderzochten retrospectief de haalbaarheid en veiligheid van het overschakelen van patiënten met IBD van Remicade naar een infliximab biosimilar in twee grote algemene ziekenhuizen in Nederland. Na het overschakelen werden de patiënten nauwlettend gevolgd door het beoordelen van de ziekteactiviteit. De concentratie C-reactief proteïne en fecaal calprotectine werd gemonitord. Bijwerkingen werden geregistreerd en de infliximabserumconcentraties gemeten. Alle parameters werden beoordeeld bij start (t = 0) en na twee infusies met een biosimilar van infliximab (± week 16). 197 patiënten met IBD (~77% van het totaal) schakelden over naar een infliximab biosimilar. Geen verschil werd waargenomen in ziekteactiviteit en concentraties C-reactief proteïne of fecaal calprotectine. Afgezien van één infusiegerelateerde reactie, werden er geen ernstige of onverwachte bijwerkingen gerapporteerd. De dalconcentraties in het serum verschilden niet tussen de uitgangswaarde en na overschakeling (mediaan = 4,1 μg/mL [spreiding = 0,03-22 μg/mL] ten opzichte van 4,6 μg/mL [spreiding = 0,03-22 μg/mL]; P = 0,08, n = 98). Deze studie laat zien dat het switchen van IBDpatiënten naar infliximab biosimilars veilig is in de klinische praktijk en zorgt voor goede en doelmatige zorg. • Binkhorst L, Sobels A, Stuyt R, Westerman EM, West RL. Switching to a infliximab biosimilar: short-term results of clinical monitoring in patients with inflammatory bowel disease. Eur J Gastroenterol Hepatol. 2018 Jul;30(7):699-703. doi: 10.1097/MEG.0000000000001113. Citeer als: Wieringa A. Veilig switchen naar infliximab biosimilars. Nederlands Platform voor Farmaceutisch Onderzoek. 2018;3:e1673.
PERSBERICHT BOGIN
januari 2019
Jean Hermans nieuwe Bogin voorzitter
Beschikbaarheid geneesmiddelen in Nederland is uitdaging
Op 1 april 2019 wordt drs. Jean M. Hermans de nieuwe voorzitter van Bogin (Biosimilars en generieke geneesmiddelenindustrie Nederland). Hermans neemt dan de voorzittershamer over van drs. Martin L.A. Favié die de functie nu zes jaar vervult en het tijd vindt om zich op andere interesses te focussen. Hermans wordt de vijfde voorzitter van de Bogin, die in 1987 werd opgericht om de belangen van patentloze geneesmiddelen te behartigen.
KNMP, VWS & NMVO
Martin Favié: “De afgelopen jaren was Hermans manager beleid en ontwikkeling bij apothekersorganisatie Koninklijke Nederlandse Maatschappij ter bevordering der Pharmacie. Voor die tijd werkte hij voor het Ministerie van Financiën en het Ministerie van Volksgezondheid, Welzijn en Sport. Hermans is ook politiek actief. Na zijn raadslidmaatschap in Leiden is hij nu lid van het algemeen bestuur van Hoogheemraadschap van Rijnland. Ook als voorzitter van de stichting Nationale Medicijnen Verificatie Organisatie (NMVO) is Hermans geen onbekende in de farma.”
Jean Hermans: “Bogin staat de komende tijd voor grote uitdagingen, waaronder: hoe houden we een groot assortiment geneesmiddelen van uitstekende kwaliteit beschikbaar voor patiënten? Daar wil ik mij graag voor inzetten.”
Bogin
Bogin is de belangenorganisatie van de fabrikanten van generieke geneesmiddelen en biosimilars in Nederland. Zij stimuleert kwaliteitssystemen en gedragscodes en houdt zich bezig met het bevorderen van de marktpositie van haar leden. Daarbij richt zij zich onder meer op het stimuleren van marktwerking en het beïnvloeden van nationale en Europese regelgeving.
De Volkskrant, 15 januari 2019
Tekort aan pillen weer toegenomen
Van Michiel van der Geest
Medicijntekorten zijn niet uniek voor Nederland. Het tekort aan bijvoorbeeld bloeddrukmedicijn Valsartan speelde wereldwijd. Veel medicijn- en grondstoffabrieken zijn gefuseerd en verplaatst naar lagelonenlanden als India en China. Het maakt de keten kwetsbaar. Wordt er ergens een vervuiling van een grondstof geconstateerd, zoals bij Valsartan, dan laten de gevolgen zich overal voelen. 'Er hoeft maar een productielijn in India te ontploffen, of een container van een schip te vallen, en je hebt een dijk van een probleem', zegt Eric Janson, directeur van de apothekersorganisatie KNMP.
Bovendien zijn die productieprocessen weinig flexibel. De Nederlandse kantoren van de internationale farmaceuten geven elk jaar aan hun hoofdkantoren door hoeveel medicijnen ze denken te verkopen. Dat gebeurt aan de hand van de contracten die zij sluiten met groothandels, zorgverzekeraars en ziekenhuizen. Op basis van al die schattingen wereldwijd plannen de farmaceuten hun productielijnen in.
Als voorbeeld: een lopende band in een fabriek produceert dan twee maanden paracetamol, dan een anti-astmamiddel en de rest van het jaar bloedverdunners. Op basis van die plannen worden de streng gereguleerde grondstoffen ingekocht en de bijsluiters gedrukt. Die planning is zo strak en ingewikkeld dat even een extra machine aanzwengelen als ergens een tekort ontstaat niet gaat. Daarom ook is een tekort niet een-twee-drie opgelost: er gaan maanden overheen voordat aan de andere kant van de wereld grondstoffen weer tot pillen voor de Nederlandse markt zijn gemaakt.
Hoewel landen als Frankrijk en België ook worstelen met medicijntekorten, zijn die in Nederland heviger dan elders, zegt Janson. Apothekers, groothandels en fabrikanten zijn het over één ding eens: dat komt door de (te) lage prijs. Door het inkoopbeleid van zorgverzekeraars en wettelijke prijsbeperkingen is sinds 2011 2,5 miljard euro op geneesmiddelen bespaard, schreef minister Bruno Bruins voor Medische Zorg vorige maand aan de Kamer.
Maar: 'De goedkope middelen zijn te goedkoop geworden', meent Janson. Het kleine Nederland met het terughoudende voorschrijfbeleid van artsen is al niet favoriet bij farmaceuten, maar bij een tekort staat ons land door de lage prijzen al helemaal achteraan voor de schaarse pillen die nog wel verdeeld kunnen worden. Kijk maar naar de anticonceptiepil, zegt Janson. Waar Nederlandse vrouwen zich in bochten moesten wringen om aan de pil te komen, waren er over de grens geen problemen.
Bruins ziet dat anders. De lage prijzen zijn een gevolg van de markt die 'effectief' zijn werk doet, schrijft hij. Tekorten liggen vooral aan problemen bij de productie en distributie. Ook zorgverzekeraars willen niets weten van de te-lage-prijzen-theorie: zeker bij merkmedicijnen zijn er genoeg landen in Europa waar de prijzen lager liggen dan in Nederland.
Fabrikanten, groothandels en apothekers houden in Nederland kleine voorraden aan, veel kleiner dan een aantal jaar geleden. Ook dat heeft te maken met de lage marge, zegt Martin Favié, voorzitter van Bogin, de branchevereniging van generieke medicijnenfabrikanten. Bij generieke medicijnen in Nederland is de winstmarge zo laag dat daar het risico van niet-verkochte voorraden niet ingeprijsd kan worden. Gevolg: de voorraden zijn zo klein mogelijk. Zijn er leveringsproblemen van een middel, dan ontstaat een run op de alternatieven. Die zijn dan dus ook binnen no-time op. 'Zie het als een supermarkt: die houdt er rekening mee dat een deel van de voorraad niet verkocht kan worden. Dat deel gaat naar de voedselbank, maar dat verlies wordt doorgerekend in de prijs die consumenten betalen. Die marge is er bij medicijnen niet.'
Verzekeraars zien dat anders: als de prijzen zo laag zijn, hoeft het aanhouden van een voorraad ook niet veel te kosten. Deze week moeten er in de werkgroep Geneesmiddelentekorten afspraken gemaakt worden die voor elk geneesmiddel in Nederland een voorraad van vier maanden garanderen. Het zou 60 procent van de tekorten moeten kunnen voorkomen, denken de groothandels.
Brexit en EU kunnen tekort opstuwen
Ook voor komend jaar houden de apothekers hun hart vast, zegt Janson. Twee nieuwe werkelijkheden kunnen de tekorten verder opstuwen. Als het op een harde Brexit uitloopt, kan dat op leveringsproblemen uitlopen. Niet alleen kent het Verenigd Koninkrijk een aantal medicijnfabrieken waarvan de export lastiger wordt, ook staat een behoorlijk aantal middelen in Groot-Brittannië geregistreerd. Die registratie geldt nu nog voor de gehele EU, maar na de Brexit niet meer.
Al die medicijnen hebben dan een nieuwe registratie in een EU-land nodig. 'Dat is slechts een formaliteit', zegt Janson, 'maar ook formaliteiten kunnen problemen opleveren.' En in februari treedt nieuwe Europese regelgeving in werking: de falsified medicine directive (FMD), die vervalsing van geneesmiddelen moet tegengaan. Het betekent dat van elk pakje moet kunnen worden gecontroleerd waar het vandaan komt. 'Ook bij de start van de FMD kan het leveren van generieke geneesmiddelen onder druk komen te staan als het aanpassen van de verpakkingslijnen in Nederland en elders niet tijdig tot stand komt', waarschuwt brancheorganisatie Bogin.
Vereniging Innovatieve Geneesmiddelen, 20 november 2018
Compensatie extra kosten Falsified Medicines Directive
De overheid gaat bedrijven compenseren voor extra kosten die zij moeten maken voor aanpassingen aan hun verpakkingen. Deze wijzigingen zijn noodzakelijk door de invoering van de Falsified Medicines Directive op 9 februari 2019. Door de Falsified Medicines Directive (FMD) moeten bedrijven hun verpakkingen aanpassen, wat tot kosten leidt voor de producenten. Die kosten kunnen niet altijd worden verwerkt door een prijsstijging, dankzij de Wet geneesmiddelenprijzen (WGP).
Bedrijven compenseren
Voor bedrijven wordt het lastig om bij lage verkoopaantallen en een lage apotheekinkoopprijs, nog een redelijke winstmarge te behouden. De overheid gaat daarom bedrijven compenseren voor die extra kosten.
Criteria VWS
Op basis van onderzoek van adviesbureau Capgemini, in opdracht van de BOGIN, stelt het ministerie VWS de volgende voorwaarden:
- de verzoeker voor het geneesmiddel waarop het verzoek betrekking heeft, heeft in 2018 een geschat volume van minder dan 250.000 verpakkingen en
- het verschil tussen de maximumprijs per verpakking en de apotheekinkoopprijs:
* bij een geschat volume in 2018 van minder dan 100.000 verpakkingen kleiner is dan € 0,34 en € 0,34
3% of meer is van de apotheekinkoopprijs;
* bij een geschat volume van 100.000 tot 250.000 verpakkingen kleiner is dan € 0,12 en € 0,12 3% of meer
is van de apotheekinkoopprijs; en
- de apotheekinkoopprijs niet hoger ligt dan de maximumprijs per verpakking.
Betaalregeling gebruiken
Dat betekent dat als bedrijven van deze betaalregeling gebruik kunnen maken als zij producten hebben die goedkoper zijn dan 11,33 euro (bij afzet van <100.000 verpakkingen) of 4 euro (bij afzet tussen 100.000 en 250.000 verpakkingen) per pakje.
Deadline aanvraag
Aanvragen moeten per e-mail worden ingediend vóór 15 december 2018, 12.00 uur. Het volledige besluit, inclusief hoe een verzoek in te dienen, is hier te vinden.
Nationaal verificatiesysteem
In de strijd tegen medicijnvervalsingen binnen het reguliere distributiekanaal geldt vanaf 9 februari 2019 een nieuwe Europese wet. Vanaf die datum moeten alle EU-landen een Nationaal Medicijnen Verificatie Systeem (NMVS) hebben. Dit betekent onder meer dat op iedere verpakking van URgeneesmiddelen (geneesmiddelen die uitsluitend op recept verkrijgbaar zijn) een unieke code moet staan.
Informatie NMVO over FMD
12 november 2018, Ministerie voor Volksgezondheid, Welzijn & Sport
Tijdelijke beleidsregels maximumprijzen geneesmiddelen ivm gedelegeerde verordening 2016/161 
17 september 2018, ZONmw
Martin Favié interviewt dr. Arend Mosterd over het LoDoCo-onderzoek
13 september 2018, European Medicines Agency
Verbetering begrip van biosimilars in Nederland
Animatie EMA met informatie over biosimilars. Klik hier.
PW, 20 juli, nr 29/30
Biosimilar van inflixamb vergelijkbaar met origineel
Overstappen van infliximab naar een biosimilar is veilig en wordt goed verdragen door patiënten met inflammatoire darmontsteking (ibd) in remissie. Strik et al voerden in 2015 en 2016 een prospectief open-label fase 4 onderzoek uit in dertien ziekenhuizen in België en Nederland. De 120 deelnemers hadden colitis ulcerosa of de ziekte van Crohn, waren in remissie en gebruikten tenminste al twintig weken origineel infliximab. De deelnemers stapten over naar een identieke dosering een biosimilar, en werden zestien weken gevolgd. De serumconcentratie werd gemeten voor de wisseling en na acht en zestien weken. De marge voor non-inferieuriteit voor de serumconcentratie na zestien weken bepaalden de onderzoekers op 15%. Het gemiddelde van de rate ratio van de serumconcentraties na zestien weken (bij gebruik van in vergelijking met de concentratie voor wisselen (bij gebruik van origineel infliximab) bedroeg 110% (90% BI 96,0-126,4) bij patiënten met colitis ulcerosa en 107,6% (90% BI 97,4-118,8%) bij patiënten met de ziekte van Crohn. Tijdens het onderzoek werden zes ernstige bijwerkingen gerapporteerd. Slechts één van deze bijwerkingen, een perianaal abces, was volgens de onderzoekers gerelateerd aan de studiemedicatie. [Lancet 2018;3(6):404-412]
PW, 5 juli 2018, nr 27/28
Aandeel merkloze medicijnen stijgt in 2017 verder naar 76%
Het aandeel generieke geneesmiddelen is in 2017 opnieuw toegenomen. Inmiddels verstrekken openbare apotheken van bijna 76% van de receptgeneesmiddelen een generieke variant. De bijbehorende kosten komen op ruim 18% uit. Hiermee behoort Nederland tot de Europese top.
Een generiek geneesmiddel is een merkloze variant van een spécialité dat op de markt mag worden gebracht als het patent van het spécialité is verlopen. Daardoor zijn de kosten van generieke middelen doorgaans veel lager dan die van spécialités. Zo maakten in 2017 generieke geneesmiddelen 75,6% uit van alle door openbare apotheken verstrekte receptplichtige geneesmiddelen uit het basispakket. Ze zijn echter slechts verantwoordelijk voor 17,9% van de kosten die apothekers voor receptplichtige geneesmiddelen declareerden bij zorgverzekeraars. Ter illustratie: een behandeling met een generiek middel kost gemiddeld € 2,66 per maand.
Europese kopgroep
Het aandeel generiek is de afgelopen jaren gestaag gestegen: van 72,4% in 2015 naar 74,1% in 2016 en in 2017 verder naar 75,6%. Hiermee behoort Nederland tot de Europese top. Volgens de meest recente cijfers (over 2015) van de OESO (Organisatie voor Economische Samenwerking en Ontwikkeling) lag het Europees gemiddelde rond de 50%, terwijl landen als Frankrijk en België rond de 30% bleven steken. Alleen Duitsland, het Verenigd Koninkrijk en Letland noteerden een licht hoger aandeel generiek dan Nederland.
Maar ons land heeft naar verhouding een veel lager kostenaandeel. In Duitsland en het Verenigd Koninkrijk is het kostenaandeel respectievelijk 36% en 39%; in Nederland was dat in 2015 maar 17%. Daarvoor zijn twee verklaringen mogelijk. Of de prijzen van generieke middelen zijn in Nederland veel lager, of die van spécialités juist relatief hoog. Het eerste ligt meer voor de hand, omdat de prijs van spécialités veelal begrensd wordt door de Wet geneesmiddelprijzen. De maximumprijzen die uit die wet voortvloeien zijn gebaseerd op de prijzen in ons omringende landen.
De lage prijzen lijken echter van Nederland een steeds onaantrekkelijkere markt te maken. Zo zijn er op dit moment leveringsproblemen bij meer dan 250 geneesmiddelen die zijn opgenomen in het preferentiebeleid van zorgverzekeraars. Apothekers grijpen daardoor dagelijks mis bij het verstrekken van generieke geneesmiddelen.
Maximale substitutie
De stijging van het aandeel generiek komt vooral doordat van meer werkzame stoffen generieke varianten beschikbaar zijn gekomen en veel minder door een stijging van de substitutiegraad. De substitutiegraad is de mate waarin apotheken generieke varianten verstrekken als multisource geneesmiddelen zijn voorgeschreven. Dat zijn geneesmiddelen waarvan door twee of meer leveranciers een generieke variant wordt aangeboden. De gemiddelde substitutiegraad is namelijk al een aantal jaren vrij stabiel, zo rond de 97%. Daarmee lijkt het maximum te zijn bereikt, want bij al meer dan de helft van de geneesmiddelen bedraagt de substitutiegraad 100%.
Aandeel verstrekkingen en kosten van receptgeneesmiddelen naar inkoopkanaal (2017)
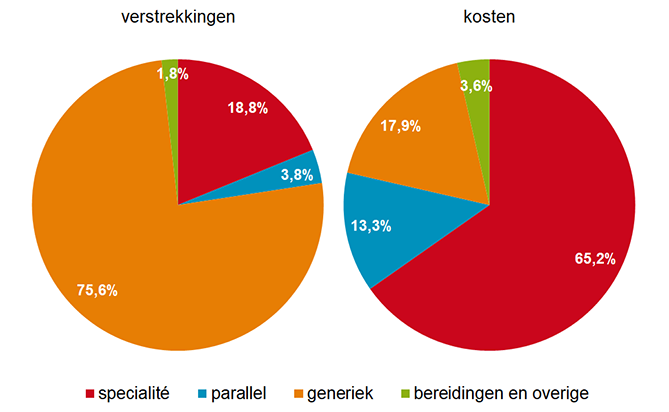
Het Financieele Dagblad, 29 mei 2018
Brussel wil export van generieke medicijnen stimuleren
Europese producenten van generieke medicijnen krijgen meer mogelijkheden om hun producten op veelbelovende markten buiten de Europese Unie af te zetten. Brussel versoepelt daarvoor wetgeving die tot dusver gepatenteerde medicijnen beschermde.
Als het aan de Europese Commissie ligt, kunnen bedrijven alvast beginnen met de productie van generieke medicijnen als het patent van de beschermde variant nog eens met vijf jaar is verlengd. Voorwaarde is dat deze medicijnen alleen zijn bedoeld voor export. Zij krijgen ook een apart logo, waarmee moet worden voorkomen dat de medicijnen alsnog op de Europese markt komen.
Grote markt
Het dagelijks bestuur van de EU motiveerde maandag het voorstel vanuit de gedachte dat de belangen van de Europese farmaciesector ermee zijn gediend. Generieke medicijnen worden steeds belangrijker. Nu al maken zij samen met zogenoemde biosimilars, een ander alternatief voor gepatenteerde medicijnen, 80% van de wereldwijde farmaciemarkt uit.
De EU speelt op deze markt ook een belangrijke rol, maar is bij de productie van generieke medicijnen in het nadeel omdat er landen zijn waar de bescherming van patenten minder streng is geregeld. Zo kennen China, India, Brazilië en Rusland geen verlengingssysteem voor gepatenteerde medicijnen. In Israël is de termijn korter dan vijf jaar en in Canada is er al een apart regime voor de export van generieke medicijnen.
Vertrek tegengaan
Het nieuwe voorstel moet voorkomen dat Europese producenten van generieke medicijnen of andere alternatieve geneesmiddelen zich buiten de EU gaan vestigen. 'We hebben een duidelijk concurrentienadeel', zo verwoordde Eurocommissaris Jyrki Katainen (banen en groei) de huidige situatie.
Volgens berekeningen van de Commissie kan een wijziging van de huidige wetgeving jaarlijks minstens €1 mrd aan extra exportopbrengsten opleveren. De EU-lidstaten en het Europees Parlement moeten nog met het voorstel akkoord gaan.
Nieuwsbrief Biosimilars Nederland #12, 2018-03 (mei 2018)
Succesvol Derde Nationaal Biosimilar Symposium
Arts, patiënt, ziekenhuisapotheker en zorgverzekeraar kunnen niet om de oncologische biosimilars heen. Dat was de eensluidende boodschap van de verschillende sprekers op het Derde Nationaal Biosimilar Symposium op donderdag 12 april jl. in Rotterdam. Met de snel stijgende kosten voor innovatieve geneesmiddelen én de vele innovaties die voor de deur staan, is het tijd de biosimilars te omarmen. Lees hier een compact verslag van de dag. Ook kunt u op de Biosimilars Nederland-website van elke presentatie, een kort verslag en de Powerpoints nalezen én alle lezingen (terug)kijken. Ook Medisch Contact maakte een verslag.

Foto: Q&A and Debate: Prof. Wojciech Jurczak, haematologist, Krakow; Prof. Xavier Pivot, oncologist, Strasbourg; Dr Paul Cornes, oncologist, Bristol
Nog één terugblik
In januari blikten we al terug op 2017, maar toen was één parel nog niet gereed: het jaaroverzicht van GaBi. Arnold Vulto, voorzitter van Biosimilars Nederland, las het en vatte de belangrijkste punten alvast voor u samen (inclusief link naar het jaaroverzicht).
Biosimilars in de huisartsenpraktijk
Biosimilars worden al tien jaar voorgeschreven door specialisten in ziekenhuizen voor onder andere bloedarmoede, een tekort aan witte bloedcellen en sinds 2015 ook voor reumatische aandoeningen. Met de komst van insuline-biosimilars krijgen ook huisartsen de beschikking over biosimilars. Hoe verloopt de ontwikkeling van deze nieuwe categorie geneesmiddelen? Internist Anton Franken en ziekenhuisapotheker Arnold Vulto, respectievelijk secretaris en voorzitter van Biosimilars Nederland, schreven hierover een artikel in het vaktijdschrift Huisarts en Wetenschap. Het artikel is bedoeld voor huisartsen en gaat met name in op de vraag hoe biosimilars in de praktijk te gebruiken. Hier is het hele artikel te lezen.
Voorzitter Biosimilars Nederland Arnold Vulto koninklijk onderscheiden
Hoogleraar ziekenhuisfarmacie en praktische farmacotherapie Arnold Vulto, en voorzitter van Biosimilars Nederland, is benoemd tot Officier in de Orde van Oranje-Nassau. Hij ontving deze eervolle en zeer verdiende onderscheiding voor de manier waarop hij farmacie en farmacotherapie een zodanige plek heeft weten te geven in de artsenopleiding, dat deze als een geïntegreerd deel van de opleiding door studenten wordt ervaren en niet als een vak apart. Daarnaast ijvert hij als sinds zijn studententijd voor werkzame, veilige en betaalbare geneesmiddelen.
Professor Vulto is sinds 1995 werkzaam als ziekenhuisapotheker/farmacoloog en sinds 2004 als hoogleraar ziekenhuisfarmacie en praktische farmacotherapie in het Erasmus Medisch Centrum. Vulto ontving zijn onderscheiding tijdens zijn afscheidssymposium ter gelegenheid van het feit dat hij op 28 april 2018 met emeritaat is gegaan. Lees meer over Arnold ‘Mr Biosimilar’ Vulto in dit interview in het Pharmaceutisch Weekblad

Foto: Na de uitreiking van de koninklijke onderscheiding ontvangen de heer en mevrouw Vulto felicitaties van toenmalige loco-burgemeester van de gemeente Pijnacker-Nootdorp de heer Jaap van Staalduine
Deze biosimilars komen eraan
Door te kijken naar welke patenten binnenkort verlopen, is een aardige inschatting te maken van welke middelen er biosimilars verwacht kunnen worden. Hoe werkt het systeem van patenten en hoe komt u erachter welke middelen de komende jaren uit patent gaan? Lees hier verder
In het artikel- gepubliceerd in GaBi Journal - vindt u uitleg en een handig overzicht.
FDA wil meer informatie
Pfizer heeft een Complete Response Letter ontvangen van de FDA. Daarin vraagt het Amerikaanse geneesmiddelenregistratiebureau om meer aanvullende informatie over de biosimilar van trastuzumab die Pfizer heeft ingediend voor goedkeuring. Het gaat dan met name om technische informatie, laat Pfizer weten. Ook de Koreaanse medicijnontwikkelaar Celltrion ontving ook zo’n brief, over haar biosimilars van trastuzumab en rituximab. Hier wil de FDA meer weten over de productiefaciliteit. Kees meer:
FDA Rejects Pfizer's Proposed Trastuzumab Biosimilar
Novartis’ Sandoz Receives CRL for Biosimilar to Roche’s Rituximab
Hoe veilig is overstappen?
Wanneer kunnen patiënten die behandeld worden met het origineel overstappen naar de biosimilar? In het artikel The design of clinical trials to support the switching and alternation of biosimilarsbespreken Freddy Faccin en collega’s het ontwerp van overstaponderzoeken van originator naar biosimilar. Promovendus Liese Barbier schreef er een beknopte kritische samenvatting over die te lezen is op de website van Biosimilars Nederland.
Verwarrende terminologie
Een biosimilar kan uitwisselbaar zijn met het innovatieve referentieproduct. Maar kunnen biosimilars onderling ook uitwisselbaar zijn? De Europese en Amerikaanse geneesmiddelenbureaus, die daarover gaan, hanteren verschillende definities, en dat kan erg verwarrend zijn in een wereld waar je niet meer weet waar de informatie vandaan komt. Welke definities dat zijn en wat dit betekent, leest u in dit artikel van Biosimilars Nederland-voorzitter Arnold Vulto.
Veiligheid overstappen gedocumenteerd
Er wordt veel onderzoek gedaan naar het overstappen van een origineel biologisch product naar een biosimilar. Twee recente mega-reviews hebben al het overstap-onderzoek in kaart gebracht. Wat komt hier uit naar voren? Lees het hier
Biopaspoort-app
Met de nieuwe app Biopaspoort van de brancheorganisatie Bogin (Biosimilars en generieke geneesmiddelenindustrie Nederland) krijgen gebruikers van biologische medicijnen meer grip op hun eigen medicijnen.
In de app kunnen patiënten zelf bijhouden welke (biologische) medicijnen ze gebruiken of gebruikt hebben. Met het opslaan van het zogeheten batchnummer of chargenummer in de app heeft een gebruiker zo zijn complete medicijngebruik in één app. Ook is via de Biopaspoort-app een eventuele bijwerking van het medicijn, met één klik, door te geven aan het bijwerkingencentrum Lareb.
Eerder dit jaar introduceerde Bogin al de website www.uwbiosimilars.nl. Deze website geeft een overzicht van en algemene informatie over biologische medicijnen en biosimilars. Biopaspoort is kosteloos te downloaden in de Apple App Store en Google Play Store.
Radio1, 11 mei 2018
Europese regels tegen nepmedicijnen kosten sector miljoenen
Nepmedicijnen Nieuwe Europese regels tegen vervalsing van medicijnen kosten de Nederlandse sector 60 tot 100 miljoen euro.
Een verzegeling van elk medicijndoosje en een unieke code op de verpakking van medicijnen gaat de sector 60 tot 100 miljoen euro kosten. Een verzegeling van elk medicijndoosje en een unieke code op de verpakking. Zo simpel lijkt de invoering van een verordening van de Europese Unie die de handel in nepmedicijnen moet tegengaan. Op 9 februari 2019 gaat de verordening in.
Maar zo eenvoudig is het in de praktijk niet. Voor de hele keten van geneesmiddelen - van fabrikant tot apotheker - betekent deze zogeheten Falsified Medicines Directive een intensieve en kostbare exercitie. Als ze niet op tijd klaar zijn, kunnen ze vanaf die datum geen geneesmiddel meer verkopen. Voor Nederlandse partijen worden die kosten geschat op 60 tot 100 miljoen euro, zo blijkt uit een reportage die Reporter Radio zondag uitzendt. Met als gevaar dat fabrikanten zich vanwege hoge kosten terugtrekken en er een verschraling van het medicijnkastje optreedt, waarschuwen betrokken partijen.
OVER DIT ARTIKEL
Dit artikel is tot stand gekomen uit een samenwerking met Reporter Radio, dat onderzoeksmateriaal heeft gedeeld met NRC. Met de in het artikel geciteerde bronnen heeft NRC zelf gesproken. De uitzending is op zondag 13 mei om 19 uur op NPO 1 en is te beluisteren via podcast. Fabrikanten moeten hun verpakkingslijnen aanpassen en soms hun fabrieken daarvoor verbouwen. Ze moeten investeren in scanningapparatuur en software. Net als groothandels en apothekers. Er komt één Europese databank, waarin fabrikanten producten aanmelden en nationale datasystemen waar apotheken producten afmelden.
Alle betrokken partijen hebben berekend wat de kosten per doosje zullen zijn. Alleen de grote farmaceuten die dure patentgeneesmiddelen op de markt brengen hebben niet zo’n berekening bekendgemaakt. Voor hen lijkt het een overzichtelijke uitgave ten opzichte van de tientallen tot duizenden euro’s die zij verdienen op een medicijn. Zij dragen alle investeringen zelf, hebben deze merkfabrikanten aangekondigd.
Lees ook: Waarom een medicijn van 1,50 euro per pil wordt verkocht voor 1.000 euro
Voor apothekers komen de kosten uit op ongeveer zes cent per doosje, heeft apothekersorganisatie KNMP becijferd. Voor de producenten van generieke geneesmiddelen (merkloze medicijnen zonder patent) komen de kosten uit op gemiddeld 17 cent per doosje. Voor die partijen drukken de kosten zwaar. Een gemiddeld doosje geneesmiddelen van 30 pillen, kost 2,39 euro. „De kosten zijn veel hoger dan bij de invoering van de verordening werd gedacht”, zegt Martin Favié, voorzitter van Bogin, de brancheorganisatie van zes grote fabrikanten van generieke medicijnen.
Lage marges
De grote vraag is wie er voor gaat opdraaien: de fabrikanten en apothekers of de zorgverzekeraars, het ministerie van VWS of de patiënten? Iedereen probeert er onderuit te komen, blijkt uit de reportage van Reporter Radio. Omdat maximumprijzen via wetten zijn vastgelegd, kan de prijs voor de patiënt niet zomaar worden verhoogd. Als niets wordt afgesproken, leveren generieke fabrikanten en apothekers in op de lage marges die ze toch al boeken.
De vrees is groot dat grote generieke fabrikanten stoppen met produceren van sommige medicijnen, waar ze kleine volumes van verkopen. Zij verkopen honderden geneesmiddelen. „Die grote generieke fabrikanten, met hoofdkantoren in Tel Aviv of New York, gaan met andere ogen opnieuw naar hun assortiment kijken, ze zullen stoppen met sommige producten als ze de kosten niet kunnen doorberekenen”, zegt Favié. Kleine leveranciers van generieke producten lijken af te wachten. Favié: „50 procent daarvan heeft zich nog niet aangemeld bij de NVMO, de nationale organisatie die toegang verschaft tot en toeziet op het centrale datasysteem. Als ze niet op tijd zijn, mogen ze vanaf 9 februari niet meer nieuwe medicijnen op de markt brengen.”
Wel mogen ze een extra voorraad op de markt brengen voor 8 februari, die daarna nog zonder codering en zegel verkocht mag worden. Favié: „Het kan zijn dat ze af willen wachten of de verordening echt gaat werken vanaf 9 februari. Maar die voorraden zijn een half jaar later echt weg.” En dat kan de tekorten van medicijnen vergroten. „Als er van een medicijn nog maar één of twee producenten overblijven, worden we heel kwetsbaar”, zegt directeur Ludwig Castelijns van groothandel Mosadex. „Er hoeft dan maar even iets mis te gaan, en we zitten zonder medicijnen.”
Lobby
In Nederland is voor zover bekend via het reguliere handelskanaal geen enkel vervalst medicijn opgedoken. Wel bij de illegale internethandel van bijvoorbeeld amfetaminen of Viagrapillen, maar die wordt door de EU-verordening niet aangepakt. In een wetenschappelijk artikel uit 2016 stelt de Deen Rasmus Borup dat de grote farmaceuten jarenlang hebben gelobbyd voor de Europese richtlijn, maar daarbij andere doeleinden zouden hebben nagestreefd dan louter het tegengaan van de handel in nepmedicijnen. Borup bestudeerde openbare en niet-openbare documenten en sprak betrokkenen. Daaruit concludeerde hij dat via deze verordening de merkfabrikanten een poging deden meer grip te krijgen op parallelhandel en één datasysteem (track and trace) te verkrijgen waarmee veel consumentendata zou kunnen worden verkregen. Eerdere lobby’s daarop gericht waren minder succesvol, maar niemand zou tegen maatregelen kunnen zijn om de publieke gezondheid te beschermen tegen nepmiddelen. De Vereniging Innovatieve Geneesmiddelen (VIG), waar de grote farmaceuten bij zijn aangesloten, zegt zich niet in de weergave van Borup te herkennen. „De patiëntveiligheid heeft altijd voorop gestaan”, reageert woordvoerder Merit Boersma. „Vervalste geneesmiddelen berokkenen grote schade en kunnen zelfs levens kosten. Mensen denken een veilig en gecontroleerd geneesmiddel van een vertrouwde fabrikant te krijgen, maar worden op het verkeerde been gezet met een medicijn waarvan de samenstelling en de herkomst niet helder is.”
Die vermeende nevendoeleinden zijn ook niet bereikt. Het datasysteem kan alleen maar gebruikt worden door nationale inspecties om op te sporen waar een vervalsing in de keten is binnengekomen. Favié: „Zoals het systeem nu is ingericht kan niemand bij de data. Je stopt je gegevens erin en dat is het.”.
Thuis checken of medicijn echt is
Alleen nu de ict-infrastructuur er ligt, blijft dat zo? Of moeten patiënten er rekening mee houden dat geneesmiddelenfabrikanten ooit wel kunnen volgen welke geneesmiddelen in hun medicijnkastjes terechtkomen? Groothandelaar Castelijns: „De fabrikanten betalen voor dat controlesysteem. En het is toch zo dat wie betaalt, bepaalt? Of waarom zou er niet een lek in het systeem komen?”
Ook kunnen de plannen veranderen. Favié: „Als het systeem vijf of tien jaar functioneert, kan natuurlijk de vraag opkomen waarom we niet meer doen met die data. Maar dan moet de patiënt er wel mee instemmen.” Merit Boersma van de VIG: „Misschien kunnen we over enkele jaren wel naar een systeem dat iedereen met een app op zijn telefoon thuis met de matrixcode kan controleren of een geneesmiddel wel echt en dus veilig is. Dat zou natuurlijk fantastisch zijn.”
Bron: Radio1
NRC, 12 mei 2018
Verschraling medicijnkast dreigt
Nepmedicijnen Nieuwe EU regels tegen vervalsing van medicijnen kost de Nederlandse sector 60 tot 100 miljoen
Door: Daan van Lent
Een verzegeling van elk medicijndoosje en een unieke code op de verpakking. Zo simpel lijkt de invoering van een verordening van de Europese Unie die de handel in nepmedicijnen moet tegengaan. Op 9 februari 2019 gaat de verordening in.
Maar zo eenvoudig is het in de praktijk niet. Voor de hele keten van geneesmiddelen – van fabrikant tot apotheker – betekent deze zogeheten Falsified Medicines Directive een intensieve en kostbare exercitie. Als ze niet op tijd klaar zijn, kunnen ze vanaf die datum geen geneesmiddel meer verkopen. Voor Nederlandse partijen worden die kosten geschat op 60 tot 100 miljoen euro, zo blijkt uit een reportage die Reporter Radio zondag uitzendt. Met als gevaar dat fabrikanten zich vanwege hoge kosten terugtrekken en er een verschraling van het medicijnkastje optreedt, waarschuwen betrokken partijen.
Fabrikanten moeten hun verpakkingslijnen aanpassen en soms hun fabrieken daarvoor verbouwen. Ze moeten investeren in scanningapparatuur en software. Net als groothandels en apothekers. Er komt één Europese databank, waarin fabrikanten producten aanmelden en nationale datasystemen waar apotheken producten afmelden.
Alle betrokken partijen hebben berekend wat de kosten per doosje zullen zijn. Alleen de grote farmaceuten die dure patentgeneesmiddelen op de markt brengen hebben niet zo’n berekening bekendgemaakt. Voor hen lijkt het een overzichtelijke uitgave ten opzichte van de tientallen tot duizenden euro’s die zij verdienen op een medicijn. Zij dragen alle investeringen zelf, hebben deze merkfabrikanten aangekondigd.
Voor apothekers komen de kosten uit op ongeveer zes cent per doosje, heeft apothekersorganisatie KNMP becijferd. Voor de producenten van generieke geneesmiddelen (merkloze medicijnen zonder patent) komen de kosten uit op gemiddeld 17 cent per doosje. Voor die partijen drukken de kosten zwaar. Een gemiddeld doosje geneesmiddelen van 30 pillen, kost 2,39 euro. „De kosten zijn veel hoger dan bij de invoering van de verordening werd gedacht”, zegt Martin Favié, voorzitter van Bogin, de brancheorganisatie van zes grote fabrikanten van generieke medicijnen.
Lage marges
De grote vraag is wie ervoor gaat opdraaien: de fabrikanten en apothekers of de zorgverzekeraars, het ministerie van VWS of de patiënten? Iedereen probeert er onderuit te komen, blijkt uit de reportage van Reporter Radio . Omdat maximumprijzen via wetten zijn vastgelegd, kan de prijs voor de patiënt niet zomaar worden verhoogd. Als niets wordt afgesproken, leveren generieke fabrikanten en apothekers in op de lage marges die ze toch al boeken.
De vrees is groot dat grote generieke fabrikanten stoppen met produceren van sommige medicijnen, waar ze kleine volumes van verkopen. Zij verkopen honderden geneesmiddelen. „Die grote generieke fabrikanten, met hoofdkantoren in Tel Aviv of New York, gaan met andere ogen opnieuw naar hun assortiment kijken, ze zullen stoppen met sommige producten als ze de kosten niet kunnen doorberekenen”, zegt Favié.
Kleine leveranciers van generieke producten lijken af te wachten. Favié: „50 procent daarvan heeft zich nog niet aangemeld bij de NVMO, de nationale organisatie die toegang verschaft tot en toeziet op het centrale datasysteem. Als ze niet op tijd zijn, mogen ze vanaf 9 februari niet meer nieuwe medicijnen op de markt brengen.”
Wel mogen ze een extra voorraad op de markt brengen voor 8 februari, die daarna nog zonder codering en zegel verkocht mag worden. Favié: „Het kan zijn dat ze af willen wachten of de verordening echt gaat werken vanaf 9 februari. Maar die voorraden zijn een half jaar later echt weg.”
En dat kan de tekorten van medicijnen vergroten. „Als er van een medicijn nog maar één of twee producenten overblijven, worden we heel kwetsbaar”, zegt directeur Ludwig Castelijns van groothandel Mosadex. „Er hoeft dan maar even iets mis te gaan, en we zitten zonder medicijnen.”
Lobby
In Nederland is voor zover bekend via het reguliere handelskanaal geen enkel vervalst medicijn opgedoken. Wel bij de illegale internethandel van bijvoorbeeld amfetaminen of Viagrapillen, maar die wordt door de EU-verordening niet aangepakt.
In een wetenschappelijk artikel uit 2016 stelt de Deen Rasmus Borup dat de grote farmaceuten jarenlang hebben gelobbyd voor de Europese richtlijn, maar daarbij andere doeleinden zouden hebben nagestreefd dan louter het tegengaan van de handel in nepmedicijnen. Borup bestudeerde openbare en niet-openbare documenten en sprak betrokkenen. Daaruit concludeerde hij dat via deze verordening de merkfabrikanten een poging deden meer grip te krijgen op parallelhandel en één datasysteem (track and trace) te verkrijgen waarmee veel consumentendata zou kunnen worden verkregen. Eerdere lobby’s daarop gericht waren minder succesvol, maar niemand zou tegen maatregelen kunnen zijn om de publieke gezondheid te beschermen tegen nepmiddelen.
De Vereniging Innovatieve Geneesmiddelen, waar de grote farmaceuten bij zijn aangesloten, zegt zich niet in de weergave van Borup te herkennen. „De patiëntveiligheid heeft altijd vooropgestaan”, reageert woordvoerder Merit Boersma. „Vervalste geneesmiddelen berokkenen grote schade en kunnen zelfs levens kosten. Mensen denken een veilig en gecontroleerd geneesmiddel van een vertrouwde fabrikant te krijgen, maar worden op het verkeerde been gezet met een medicijn waarvan de samenstelling en de herkomst niet helder is.”
Die vermeende nevendoeleinden zijn ook niet bereikt. Het datasysteem kan alleen maar gebruikt worden door nationale inspecties om op te sporen waar een vervalsing in de keten is binnengekomen. Favié: „Zoals het systeem nu is ingericht kan niemand bij de data. Je stopt je gegevens erin en dat is het.”
Over dit artikel
Dit artikel is tot stand gekomen uit een samenwerking met Reporter Radio , dat onderzoeksmateriaal heeft gedeeld met NRC . Met de in het artikel geciteerde bronnen heeft NRC zelf gesproken.
PW18 - 04-05-2018
Optimaal medicijngebruik ligt voor de hand, toch gaat veel mis’
Arnold Vulto neemt na 22 jaar afscheid van het Erasmus MC
door: Frans van den Houdt
De opleider, de onderwijzer, de European, mr. Biosimilar; professor Arnold Vulto (66) kreeg in zijn lange carrière vele bijnamen. Meest trots is hij op zijn unieke onderwijssysteem waarin apothekers geneeskunde-studenten kennis over geneesmiddelen bijbrengen. Begin april nam Vulto na 22 jaar afscheid van het Erasmus MC.
“Kennis moet niet in een ivoren toren blijven. Die moet beschikbaar komen voor mensen voor wie deze is bedoeld: patiënten. Die gedachte loopt als een rode draad door mijn carrière, met als doel het optimaliseren van geneesmiddelgebruik. Ervoor zorgen dat patiënten toegang hebben tot werkzame, veilige en betaalbare geneesmiddelen. Het lijkt zo voor de hand te liggen, maar helaas gaat nog heel veel mis.
Tijdens mijn studie raakte ik verzeild in de werkgroep Wetenschap en Samenleving met onder anderen Henk Buurma en Dries de Kaste van de Groningse faculteit Farmacie. Wij waren allemaal met dat optimalisatieproces bezig en schreven columns voor publieksbladen als Mensen van Nu over zelfmedicatie en goed geneesmiddelgebruik.
Er was veel discussie over zelfmedicatie. Fenacetine was een populair bestanddeel van pijnstillers, het zat bijvoorbeeld in Chefarine 4. Het is een nefrotoxische stof en de werking ervan was onduidelijk. Wij wisten dat er een heel gevecht aan de gang was tussen industrie en beleidsmakers – CBG en de toenmalige Geneesmiddelencommissie van het ministerie van VWS – die vonden dat we van fenacetine af moesten. Het maakte dat mensen verslaafd raakten aan pijnstillers. En bij degenen die veel pijnstillers met fenacetine slikten gingen de nieren kapot.
Onze columns trokken de aandacht van de Consumentenbond. Ze wilden een serie artikelen maken over de zin en onzin van zelfzorgmiddelen en vroegen ons de wetenschappelijke beoordeling te doen. Vanuit dezelfde gedachte dat er ook geneesmiddelen op de markt waren die je maar beter niet kunt gebruiken, ontstond het idee om vervolgens receptmiddelen te gaan beoordelen. We waren welhaast pathologisch ambitieus en er in onze jeugdige onschuld van overtuigd dat we dat varkentje wel konden wassen. Achteraf heb ik vaak gedacht: hoe hebben we het voor elkaar gekregen? Maar uiteindelijk kwam een mooi boek tot stand.
We begonnen met makkelijke geneesmiddelengroepen. Er was een hoop humbug rond vaatverwijders, die zouden de hersenfunctie verbeteren door de bloedvaten te verwijden. Er gebeurde van alles als je die middelen slikte, maar invloed op de hersenen bleef achterwege. We schreven een proefhoofdstuk, vormden een redactieraad en zijn onder leiding van Lucas Reijnders van de Universiteit Groningen aan de slag gegaan. Dat resulteerde eind 1980 in het boek Geneesmiddelen in Nederland. Het werd een groot succes, het boek haalde zeventien drukken.
Maar we ondervonden behoorlijk wat tegenwind. Door sommigen werden we verguisd. Polemieken in de kranten. We waren niet deskundig genoeg, gingen op de stoel van de dokter zitten en schaadden de vertrouwensband tussen arts en patiënt. Bij een kwart van de middelen hadden we aangegeven dat ze beter verboden konden worden. Soms werd daarom gedreigd met een rechtszaak. Toen we werden gedagvaard voor de bewering dat een bepaald middel mogelijk oncogeen was, zijn we gaan graven in de annalen van de fabrikant, Schering in Berlijn. We ontdekten dat prof. Nelemans, een zeer erudiete hoogleraar Farmacotherapie in Utrecht, die ook in het CBG en de Geneesmiddelencommissie zat en als getuige-deskundige werd opgevoerd door de Duitse firma, ook adviseur was van datzelfde bedrijf. We schreven een briefje dat hier sprake was van een ongelijke strijd, aangezien zij een deskundige hadden die A: op hun payroll stond, en B: inzage had in alle documenten van het CBG. Daarna bleef het doodstil.
Ik heb gigantisch veel geleerd in die periode. Ook om diplomatiek te opereren. In mijn studententijd – 1974 – zat ik in de congrescommissie van studentenvereniging ANPSV (tegenwoordig KNPSV) en werden we op het matje geroepen door de KNMP. Leuke jongens als we waren hadden we als motto voor ons congres ‘De farmaceut als therapeut’ bedacht. Daar ligt nu niemand van wakker, integendeel. Maar toen was het een brug te ver. Het zou gedonder geven met de dokters. Bovendien zou de discussie over het motto afleiden van onze boodschap. We veranderden de congrestitel daarom in ‘De apotheker als adviseur’.
Mr. Biosimilar
Na bij het Erasmus MC terecht te zijn gekomen, raakte ik ook verzeild in The European Association of Hospital Pharmacists en het tijdschrift van de vereniging, The European Journal of Hospital Pharmacy, waardoor ik al snel tegen biosimilars aanliep. Ik ben me daar in 2004 in gaan verdiepen. Aanvankelijk uit bezorgdheid over de kwaliteit, maar die bleek ongegrond; de generieke fabrikanten bleken prima producten te leveren. Het gebrek aan goed toegankelijke, onafhankelijke informatie leidde in 2008 tot de oprichting van GaBI, het Generics and Biosimilars Initiative, in 2013 gevolgd door Biosimilars Nederland.
Ook hier geldt het principe: hoe krijg je de beste, betaalbare geneesmiddelen bij de patiënt. Het kaf van het koren scheiden. Een gevleugelde uitspraak van collega’s luidde: ‘bij Arnold gaat het om de vraag: moet het in het drinkwater of moet het middel het raam uit?’. Is het goed voor ons allemaal, of moeten we het vooral niet gebruiken?
Met finaal uit de pan rijzende geneesmiddelenkosten werden biosimilars steeds interessanter voor ziekenhuizen, ook voor het Erasmus MC, al was en is er terughoudendheid bij dokters. Mijn ziekenhuis vond dat ik mijn kennis en ervaring op dit gebied moest terugploegen in de organisatie en gaf me een soort ambassadeursfunctie. Zo is de titel mr. Biosimilar ontstaan.
Bij een aantal specialisten heerst nog steeds scepsis. Maar ook bij patiënten. Zij gebruiken een middel waarbij ze zich goed voelen en moeten dan ineens overstappen op iets dat onbekend is en van een onbekende fabrikant komt. Die weerstand begrijp ik heel goed. Merkfabrikanten zorgen ondertussen voor grote klantenloyaliteit, ook bij dokters. Maar twijfels over de kwaliteit van biosimilars zijn volkomen onterecht. Ze zijn gemaakt met 21ste-eeuw-technologie, terwijl de innovators uit de vorige eeuw zijn. Dat zie je. Biosimilars zijn in een aantal gevallen gewoon beter, zuiverder, stabieler.
Een overstap naar een biosimilar leidt in 99% van de gevallen niet tot problemen. Waar dat wel het geval is hebben we te maken met het nocebo-effect. Dat de patiënt vooringenomen is, en we weten dat patients’ beliefs sterk bepalend zijn voor de uitkomst van de therapie. Daarbij speelt ook de houding van de voorschrijvende dokter een rol van betekenis. Als die tegen de patiënt zegt: ‘uw huidige middel werkt prima bij u, maar ik moet van het ziekenhuis iets anders voorschrijven omdat dat goedkoper is’, bevordert dat het patiëntvertrouwen niet.
Vuiltje
Er zit overigens nog wel een vuiltje in de lucht. Een succesvolle biosimilarstrategie is gebaseerd op vier principes: alle betrokkenen bij elkaar brengen, de neuzen dezelfde kant op krijgen en de patiënt erbij betrekken. Hem ervan overtuigen dat de biosimilar net zo goed is, maar hoge besparingen oplevert. Daarvoor gaan we gezondheidswerkers trainen in shared decision making. Zodat de patiënt achteraf niet zegt: ‘ik ben belazerd, of heb het gevoel dat ik belazerd ben’. Punt vier, en daar zit het vuiltje, betreft de vraag: waar gaat het bespaarde geld heen?
Dat moet echt opgelost worden, anders denk ik dat het enthousiasme om biosimilars te gaan gebruiken zal afnemen. Als aan het eind van het jaar de verzekeraar tegen het ziekenhuis zegt: ‘u heeft een mooie besparing bereikt, die steek ik in m’n zak’, roept iedereen natuurlijk: ‘maar daar hebben we het niet voor gedaan’. Dat is zorgelijk, het bedreigt het hele biosimilarproces. In een land als Engeland is het standaard dat de helft van de besparing naar de National Health Service gaat en de andere helft wordt teruggeploegd in de betreffende afdeling van het ziekenhuis om de zorg te verbeteren. Dat is voor iedereen een win-winsituatie.
Extremen in onderzoek
Het onderzoek in de apotheek van het Erasmus MC betrof de extremen van het geneesmiddelenspectrum. Enerzijds de optimalisering van het gebruik van bestaande geneesmiddelen en anderzijds grensverleggende advanced therapies, zoals gentherapie en celtherapie. In Rotterdam zijn we aan de slag gegaan met transplantatiegeneeskunde, kinderfarmacie en biotechnologie. Dat laatste deed toen nog niemand in Nederland. Heel vreemd, want wij vonden als ziekenhuisapothekers dat dat de toekomst was. Ongeveer een derde van de nieuwe geneesmiddelen die geregistreerd worden zijn inmiddels biotechnologische geneesmiddelen. Maar kijk je naar het curriculum van de apothekersopleiding en doktersopleiding dan zit er nog relatief weinig in over biotechnologie.
Ons gentherapeutisch onderzoek in het Erasmus MC heeft mooie dingen opgeleverd. Grensverleggend is het proof of principle dat gentherapie bij de ziekte van Pompe mogelijk moet zijn, als alternatief voor het peperdure Myozyme. Een fascinerende trip was voor mij het onderzoek van Anna de Goede naar de ontwikkeling van een hiv-vaccin op basis van het griepvaccin. Het verleggen van grenzen moet, vind ik, ook de core business zijn van een academisch ziekenhuis en daar moet de apotheek zijn rol in spelen.
In 2010 heb ik een sabbatical genomen, omdat ik vond dat ik te weinig kennis had over moleculaire biologie. Ik was jaloers op promovendi als Anna de Goede die na vier maanden zei: ‘ik heb m’n eerste eigen virus gemaakt’. Sodeju, dacht ik, dat kan ik nou niet. Dat bleef smeulen. In het Duitse Paul Ehrlich Instituut heb ik het toen ook geleerd. Kennis die ik nodig had om gentherapieprogramma’s van onze onderzoekers goed te kunnen ondersteunen.
Medicatieveiligheid
Patricia van den Bemt doet voortreffelijk werk op het gebied van medicatieveiligheid, maar dit is natuurlijk een heel treurig probleem. We schatten dat jaarlijks tussen de vijfhonderd en duizend doden vallen in ziekenhuizen door ontspoord geneesmiddelgebruik. Omdat iemand even niet heeft opgelet. Een maatschappelijke schande.
Ziekenhuisfarmacie is voor mij altijd voorwaardenscheppend geweest; de apotheek moet voorwaarden scheppen voor een optimale therapie in het ziekenhuis. Therapie die wordt ingesteld door de dokter en wordt uitgevoerd door verpleegkundigen. We moeten constateren dat dat niet goed gelukt is. Misschien is het geneesmiddelengebruik in ziekenhuizen wel te complex geworden. Daarom sturen we nu apothekers en assistenten zelf naar de verpleegafdeling. We hebben van alles gedaan: dokters en verpleegkundigen getraind en hulpsystemen ingezet. Maar het eind van het liedje is dat het onvoldoende resultaat heeft opgeleverd. Daarom gaan we nu het behandelaarschap van de apotheker verder ontwikkelen.
De apotheker moet zich meer direct met de farmacotherapie gaan bezighouden. Op zich prachtig, een mooie uitdaging, maar het had niet nodig hoeven zijn. Er is een leemte ontstaan die we als ziekenhuisapothekers gaan opvullen om de risico’s van geneesmiddelengebruik beheersbaar te maken.
De roeptoeter
Waar ik apentrots op ben is dat ik van het Erasmus de unieke kans kreeg een onderwijssysteem te bouwen waarin apothekers de eerstverantwoordelijken zijn om geneeskundestudenten te leren hoe ze verantwoord moeten omgaan met geneesmiddelen. Ik fungeerde als roeptoeter. Het was een soort zendingsdrang van mij, direct gekoppeld aan die rode draad in mijn carrière. Een goede behandeling begint bij dokters die weten hoe ze moeten voorschrijven, werkzaam, veilig en kostenbewust. Vanaf studiejaar één doceert de apotheker over geneesmiddelen en aan het eind van de rit moeten ze examen doen bij een apotheker om hun voorschrijfbevoegdheid te halen.
Ik heb altijd ingezet op een optimale samenwerking tussen artsen en apothekers. Dat is effectiever dan alleen vanaf de bühne blijven roepen hoe belangrijk het is. Door de Rotterdamse aanpak appreciëren dokters al vroeg de rol van de apotheker; dat ze weten dat hij dé deskundige is op het gebied van geneesmiddelen. Dat als hij iets voorstelt, hij daarover eerst drie keer goed heeft nagedacht. De apotheker moet het rotsvaste baken zijn in de behandeling van patiënten met geneesmiddelen, waarop de dokter blind moet kunnen vertrouwen. In Rotterdam is dat goed gelukt. Daarop kijk ik na 22 jaar met voldoening terug.”
Leerstoel in teken biosimilars
Arnold G. Vulto (1952) was de afgelopen 22 jaar verbonden aan het Erasmus MC als hoogleraar ziekenhuisfarmacie en praktische farmacotherapie. Hij behaalde zijn farmaciediploma aan de Universiteit Groningen, specialiseerde zich in ziekenhuisfarmacie in het universiteitsziekenhuis Maastricht en promoveerde in Utrecht. Hij is medeoprichter van GaBI (Generics & Biosimilars Initiative) en Biosimilars Nederland en geeft over de hele wereld lezingen over biosimilars. In april 2018 kreeg hij de onderscheiding Officier in de Orde van Oranje-Nassau.
Biosimilars op maat (BOM)
Het ministerie van VWS financiert via Biosimilars Nederland en in samenwerking met het Instituut voor Verantwoord Medicijngebruik (IVM) een groot, driejarig project, genaamd BOM (biosimilars op maat) om in ziekenhuizen voorlichting te geven en te helpen barrières te overwinnen. Een soortgelijk project is nodig in de eerste lijn, zegt Arnold Vulto. “De eerste lijn is moeilijker, want veel diffuser.”
8 mei 2018, Pharmaceutisch Weekblad
Mr. Biosimilar
Het is uiterst aangenaam hoogleraar Arnold Vulto te horen vertellen over verleden, heden en toekomst van de farmacie, over medicatieveiligheid, opleidingen en gentherapie. En natuurlijk over biosimilars. Als dé autoriteit, zowel nationaal als internationaal, is zijn bijnaam mr. Biosimilar daarom zondermeer op z’n plaats.
Bestond aanvankelijk ook bij hem enige scepsis over de kwaliteit van deze generieke producten, hij kwam er al snel achter dat ze op geen enkele manier onderdoen voor de duurdere biologicals. Inmiddels zijn bijna veertig biosimilars geregistreerd, voor alle belangrijke geneesmiddelgroepen en Vulto schat dat dat er in 2020 zo’n zeventig zullen zijn. Dat betekent enorme besparingen die kunnen oplopen tot zo’n € 350 miljoen per jaar, afgaande op cijfers van de zorgautoriteit over aflopende patenten. “Dat is € 1 miljoen per dag”, zegt Vulto, “een bedrag dat zomaar op straat ligt. De vraag is: rapen we het op of niet?”
Het ministerie van VWS is altijd enthousiast als het om besparingen gaat en financiert daarom via Biosimilars Nederland een driejarig project, BOM genaamd (biosimilars op maat), om in ziekenhuizen voorlichting te geven en te helpen barrières te overwinnen.
Een soortgelijk project is volgens Vulto nodig voor de eerste lijn. Geen eenvoudige exercitie want gaat het bij ziekenhuizen om zestig tot tachtig instellingen, in de eerste lijn gaat het om veel grotere aantallen in een heel gedecentraliseerd veld. Dat maakt het veel moeilijker om iedereen te bereiken, wat het noodzakelijk maakt goed na te denken over een communicatiestrategie, benadrukt Vulto.
Na 22 jaar heeft hij begin april afscheid genomen als hoogleraar Ziekenhuisfarmacie en Praktische Farmacotherapie van het Erasmus MC, maar hij blijft zich nog op veler fronten inzetten voor de farmacie. Met één onderzoeker blijft hij meedenken over een oncolytische virustherapie voor pancreaskanker en samen met een groepje andere wetenschappers gaat hij proberen het heel oude kankermiddel floxuridine weer te reanimeren, een geneesmiddel dat door zijn unieke eigenschappen volgens Vulto heel effectief is bij leverkanker. En ongeveer één dag in de week blijft hij aan BOM besteden.
1 mei 2018, ZonMW
Favié over GGG Congres (19 apr jl.), met name over subsessie Drug Rediscovery
Klik hier voor het item.
30 april 2018, Consultancy.nl
Lage prijzen van goedkope, veelgebruikte medicijnen leiden tot tekorten
Tekorten van goedkope en veelgebruikte medicijnen komen in Nederland steeds vaker voor. Uit onderzoek van Berenschot komt naar voren dat deze ontwikkeling (deels) is toe te schrijven aan het gevoerde preferentiebeleid, waarbij zorgverzekeraars een overeenkomst sluiten met de fabrikanten van geneesmiddelen en alleen nog de door hen geproduceerde medicijnen vergoeden. Omdat dit wel heeft bijgedragen aan het beperken van de medicijnkosten, pleit Berenschot niet voor een afschaffing van het beleid. Wel stelt het enkele aanpassingen voor om de tekorten tegen te gaan. .jpg)
De betaalbaarheid van de zorg in Nederland staat steeds verder onder druk. Nieuwe behandelingen zijn duur, personeelskosten lopen op en de bevolking vergrijst. Een van de middelen die zijn ingezet om de zorgkosten enigszins binnen de perken te houden, is het zogenaamde preferentiebeleid. Dit beleid is van toepassing op generieke geneesmiddelen, oftewel (goedkope) medicijnen waar geen patent meer op zit en die voornamelijk worden voorgeschreven door huisartsen. De zorgverzekeraars sluiten een overeenkomst met de producenten van dergelijke medicijnen, waarmee de vergoeding voor verzekerden wordt beperkt tot een product van die fabrikant.
Het beleid bestaat sinds 2008 en wordt vandaag de dag gevoerd door de vier grote Nederlandse zorgverzekeraars – Zilveren Kruis, VGZ, CZ en Menzis – die gezamenlijk zo’n 90% van de markt in handen hebben. Hierbij houdt elk van de verzekeraars er zijn eigen versie van het beleid op na. Terwijl de invoering heeft geleid tot het gewenste effect – de uitgaven aan door huisartsen voorgeschreven medicijnen daalden tussen 2010 en 2016 van €5,2 miljard naar €4,5 miljard – wezen verschillende partijen binnen de zorg er de afgelopen jaren op dat het mogelijk een onwelkome bijwerking had: zij vermoedden dat het scherpe inkoopbeleid een belangrijke rol speelt in de oplopende geneesmiddelentekorten waar ons land tegenwoordig mee kampt.
De verzekeraars, aan de andere kant, bestrijden dat de tekorten een gevolg zijn van hun inkoopbeleid. Om deze patstelling te doorbreken, schakelden enkele van de partijen die wel een verband zien – de KNMP, Bogin en de Vereniging Innovatieve Geneesmiddelen* – adviesbureau Berenschot in om onderzoek te doen naar de effecten van het preferentiebeleid van zorgverzekeraars op de beschikbaarheid van geneesmiddelen. Het adviesbureau voerde kwantitatieve analyses en een documentstudie uit en nam interviews af. De onderzoekers stellen op basis van de resultaten hiervan dat het zeer aannemelijk is dat er inderdaad een verband bestaat tussen het preferentiebeleid en de toegenomen medicijntekorten.
Nederlands lege medicijnkastje
Deze conclusie bereikten ze door ten eerste de situatie in Nederland te vergelijken met die in andere EU-landen. Hieruit blijkt dat de uitgaven aan geneesmiddelen per hoofd van de bevolking in Nederland tussen 2009 en 2015 sterker zijn gedaald dan in België, Denemarken, Duitsland, Frankrijk, Spanje en de UK. Tegelijkertijd ligt het aantal gerapporteerde tekorten in die landen (veel) lager dan in Nederland. In 2010 waren er nog minder dan 200 medicijnen langere tijd niet leverbaar, in 2015 waren dat er 645 en in 2016 al 710. Het gaat hierbij om veelgebruikte middelen als bloeddrukverlagers en kalmeringsmiddelen.
“Het is voorstelbaar dat het relatief grote aantal tekorten in Nederland samenhangt met relatief lage geneesmiddelenprijzen, een relatief kleine markt en een relatief hoog gebruik van generieke geneesmiddelen”, merken de onderzoekers op. Hierbij maken ze ook nog de kanttekening dat de rapportage in andere landen waarschijnlijk minder goed is dan in Nederland en dat het gebruik van afwijkende definities de vergelijking verder bemoeilijkt. Ook geven ze aan dat terwijl andere landen ook tekorten kennen, het probleem in Nederland ernstiger is omdat fabrikanten bij schaarste eerder leveren aan landen waar de prijzen hoger liggen.
Goedkope pillen sneller op
Ten tweede keek Berenschot naar welke medicijnen het vaakst niet beschikbaar waren. In 2009 bedroegen de tekorten aan preferent aangewezen middelen 8% van het aantal geneesmiddelentekorten en in 2016 was dit aandeel opgelopen tot 18%. Hieruit blijkt dat het aantal tekorten van preferent aangewezen middelen in die periode een stuk sterker toenam dan dat van geneesmiddelen in het algemeen. Ook de tijdelijke tekorten aan preferente middelen liepen in deze periode harder op dan die van geneesmiddelen in het algemeen. Op dit gebied is het verschil bovendien nog een stuk groter.
Ook worden er leveringsproblemen geconstateerd bij niet-preferente medicijnen die wel in het preferentiecluster vallen. Zo’n cluster bestaat uit geneesmiddelen die qua werking en toediening met elkaar overeenkomen. Binnen een preferentiecluster wijst de verzekeraar één of meerdere middelen aan die worden vergoed. Terwijl een niet preferent middel uit het cluster niet wordt vergoed, valt het vanwege de inclusie binnen het cluster wel binnen het beleid. Volgens de onderzoekers heeft het beleid bovendien indirect invloed op de beschikbaarheid van deze medicijnen: “Een tekort van het preferent aangewezen geneesmiddel werkt door op andere middelen in hetzelfde cluster”, geven ze aan.
Beleidsaanpassingen
Om de negatieve effecten van het scherpe prijsbeleid van de Nederlandse zorgverzekeraars te beperken, doet Berenschot vijf aanbevelingen. De eerste vier hiervan zijn gericht op de leveringszekerheid. Zo adviseert het bureau ten eerste om bij het aanbesteden van preferente middelen aan te dringen op strengere voorwaarden, zoals scherpere eisen ten aanzien van de continuïteit van levering. In dit kader kan er daarnaast rust in de markt worden gecreëerd door de duur van de aanbestedingen – die nu één jaar is – te verlengen naar periodes van meer dan twee jaar, en door snel bekend te maken welke geneesmiddelen als preferent worden aangewezen.

Ten tweede moeten de geneesmiddelentekorten beter worden gemonitord, met name ten aanzien van de preferente medicijnen. Dit kan door tekorten snel te melden en op te lossen, door een eenduidige wekelijkse lijst op te stellen met alle niet-leverbare, preferent aangewezen geneesmiddelen en door een strengere handhaving op de naleving van de contractafspraken. Het derde advies is om het preferentiebeleid bij terugkerende tekorten te versoepelen. Zo kan aan apothekers de vrijheid worden gegeven om de patiënt bij een tekort het beste alternatief te bieden, zonder financiële consequenties. Ook kan er bij veelvoorkomende tekorten meer dan één geneesmiddel als preferent worden aangewezen en kan een middel zijn preferente status worden afgenomen als de prijs ervan na enige jaren preferentiebeleid op een vergelijkbaar niveau blijft.
Ten vierde kan het preferentiebeleid worden ingeperkt in geval van bewezen slechte leverbaarheid. Wanneer een fabrikant zijn middel in een bepaald jaar niet kan leveren, kunnen de verzekeraars ervoor kiezen dat middel het volgende jaar niet meer aan te wijzen als preferent. Ook kunnen ze strengere eisen stellen aan fabrikanten die vaker leveringsproblemen met preferente middelen hebben laten zien in het verleden.
De vijfde en laatste aanbeveling richt zich niet op de leveringszekerheid, maar op een vereenvoudiging van het preferentiebeleid. Zo wordt geadviseerd een beperkte lijst preferente geneesmiddelen in te voeren. “Dat zou het voorraadbeheer in de keten vereenvoudigen, waardoor ‘tekorten’ die in de keten optreden worden ingeperkt”, aldus de onderzoekers. Daarnaast kan het beleid soepeler zijn ten aanzien van patiënten die het aantal keren dat ze moeten switchen in verband met leveringsproblemen willen beperken: “Als een patiënt middel A gebruikt, en A is niet meer leverbaar, dan wordt gewisseld naar middel B. Als A dan wel weer leverbaar is, kan voor die patiënt ook middel B worden vergoed om verwarring te voorkomen.”
Aanhoudende onenigheid
Terwijl Gerben Klein Nulent van de KNMP zich schaart achter de bevindingen uit het rapport en stelt dat de tekorten aan alledaagse geneesmiddelen “verschrikkelijke vormen” aannemen, waarmee hij onderstreept dat de tijd is gekomen voor een versoepeling van het preferentiebeleid, lijken de zorgverzekeraars vooralsnog minder overtuigd. Henk Eleveld van Menzis stelt dat de conclusies van Berenschot “aanvechtbaar” zijn', omdat volgens hem slechts een beperkt deel van de tekorten te verklaren valt door het scherpe inkoopbeleid. Hij voegt toe een daling van de tekorten te verwachten nu verzekeraars de levering van generieke medicijnen strikter zijn gaan controleren.
Stijging aandeel generieke verstrekkingen in 2020